水素貯蔵材料
水素社会
この数10年の間、世界中の技術先進国は石油や天然ガスなど従来のエネルギー源に代わるエネルギーとして、「水素」に研究開発の重点を置いてきました。水素は、増加し続けるエネルギー需要と地球規模の気候変動に対する切り札と考えられています。実際、水素は化石燃料、再生可能なエネルギー、水などのさまざまなエネルギー源(原子力、風力、太陽光エネルギーなどを含む)から製造できます。水素は無毒で、エネルギーに変換したときの唯一の廃棄物は水であるため、極めて環境にやさしいエネルギー担体です。水素燃料の利用でCO2排出量の削減が期待され、カーボンニュートラル・脱炭素社会の実現にも貢献することが可能です。
このように明らかな利点があるにもかかわらず、水素経済の実現には多くの課題が山積しています。水素ステーション向けの小規模な輸送方法(圧縮・液体水素)は実現されていますが、石油や天然ガスと異なり、水素には輸送をサポートする大規模なインフラストラクチャーがありません。水素は化学産業や精製分野で日常的に使用されていますが、多くのエネルギー用途にとって水素の貯蔵と輸送のコストは高すぎるため、水素を主なエネルギー担体として使用してエネルギーを貯蔵・輸送する水素経済の導入が妨げられています。
水素経済インフラストラクチャーは、製造、輸送、貯蔵、変換、および応用という5つの主要要素で構成されます(図1)が、これら各要素では、技術的な発展段階が異なっています3,15。
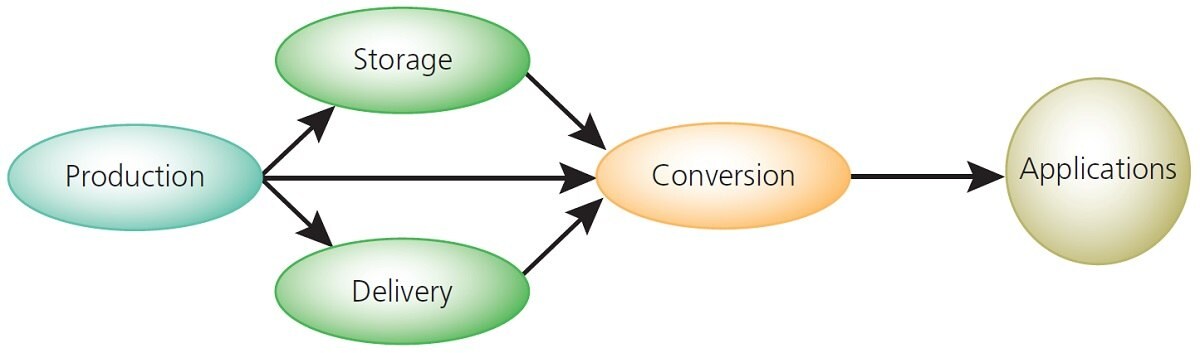
図1 水素経済インフラストラクチャー
水素の製造と変換はすでに技術的に実現可能ですが、輸送と貯蔵については難しい課題を抱えています。たとえば、水素は鋼を脆化させる可能性があるため、既存の天然ガス輸送システムは、純水素ガスの輸送には適さない場合があります。したがって、天然ガスとの混合、圧縮ガスまたは極低温液体輸送のほか、代替となる水素担体(メタノール、エタノール、その他の有機液体)など、他の選択肢が検討されていますが、市場にあるどの選択肢もエンドユーザーのニーズを満たしていません。現在、アンモニアボランをはじめとするホウ素化合物、水素化物、アミド、複合材料、有機金属構造体(MOF)、有機分子などを使用した水素貯蔵への材料ベースのアプローチが、幅広く探究されています。
水素吸蔵材料 ―金属合金―
水素吸蔵(貯蔵)合金とは、気相から、または電気化学的に大量の水素を可逆的に吸収および放出できる独特の性質を持った金属材料です(図2を参照)。水素吸蔵合金のこのユニークな性質は、充電式電池や冷却素子、燃料電池用水素貯蔵システムに応用されています1。

図2 水素吸蔵反応の模式図
現在まで研究されてきた幅広い種類の水素吸蔵合金の中では1,2、水素吸蔵能力の高さと運用条件の面で、AB5およびAB2型合金の2つのグループが最も優れています。
AB5合金は水素化物を作る金属Aと水素化物を作らない金属元素Bを組み合わせたもので、通常、Aは希土類金属(La、Ce、Nd、Pr、Y、またはミッシュメタルと呼ばれる希土類元素混合物)で、Bはニッケルです。ニッケルはCo、Sn、Alなど他の金属をドープすることで材料の安定性を改善したり、水素の吸蔵または放出に必要な平衡水素圧や温度を調節したりできます2。
AB2合金はラーベス相としても知られ、AサイトにTi、Zr、またはHfを持ち、Bサイトに遷移金属(Mn、Ni、Cr、V、その他)を持つ合金です。このグループの材料はAB5型合金の可逆的な水素吸蔵能力とほぼ同じ能力を持っています。その一方で、AB2合金は高い水素圧においてより多くの水素を吸蔵することができ、電池の負極として使用した場合、速い放出速度でより高い吸蔵能を持ちます2。AB5型およびAB2型合金は、適度に高い水素吸蔵能力(1.4~1.6 wt.%)と安定した性能を持つことから、ガス吸着システムを使用した水素吸収および脱離実験での優れた標準物質として使用できます3。下記水素吸蔵用合金シリーズは、デモ用や新しい水素吸蔵材料および電池材料開発での標準物質として使用できます。
水素貯蔵材料 ―金属水素化物―
水素化マグネシウム, MgH2
可逆性を持ち、空気中で安定。貯蔵容量:約7%、動作圧力:約20atom、動作温度:250-400℃

MgH2は古くから知られている軽量で熱力学的に安定な水素吸蔵化合物ですが、水素放出に高温が必要であったり放出速度が遅いため、遷移金属をドープさせることで性能の改善が図られています4-8。
アルカリ金属アラナート(M+[AlH4]-)
NaAlH4 ( M = Na )
可逆性を持ち、空気・水分に敏感。貯蔵容量:5.5wt%まで(粉末:685984)

THF中のNaAlH4溶液の電気分解9によって、水素含有率が重量で10%、水素放出温度が約100℃の水素化アルミニウム(AlH3)が生成されます。これによって、水素輸送に関して熱力学的にも速度論的にも条件を満たした低コストの水素貯蔵システムの開発が可能になります10。
LiAlH4( M = Li )
水分に敏感。貯蔵容量:7.9wt%まで(686034)

LiAlH4はこれまで再生するために厳しい条件が必要でしたが、THF溶液中Ti触媒の存在下で、低温低圧で可逆的に再生することが可能になりました11。
水素貯蔵材料 ―金属アミド―
LiNH2、Li3N
可逆性で、水分に敏感。貯蔵容量:10.4wt%まで、動作温度:200-300℃/10atom)

水素貯蔵材料―ホウ素化合物―
ホウ素は、大量の水素と結合しマイルドな実験環境で放出可能な性質をもつ元素に分類されます。現在、ホウ素をベースとした化合物は重量にして19%までの水素を蓄えることができ、100℃から400℃の温度範囲にて、もしくは適切な化学処理によって放出が可能です3,16,17。
ホウ素を用いた水素貯蔵の研究における材料カテゴリには、まず、アルカリ金属、アルカリ土類金属(リチウムやナトリウム、もしくはカルシウムやマグネシウム)の水素化ホウ素化合物(686026, 685917, 686018, 715247, 695254)3があります。前者の場合、金属触媒の存在下で水溶液中にて可逆的な水素放出が可能です19。

2つ目は、ボラン(BH3)とアンモニアの単純な錯体をベースとしたもので、アンモニア-ボラン錯体(H3N-BH3, 682098)3,20が知られており、100℃以上の温度において段階的に約13%の水素を放出します。また、リチウムアンモニアボラン18が優れた水素放出特性を持つことが明らかになっています(水素吸蔵量:13.5 wt%、水素放出温度:90℃)。最近では、Ca(BH4)2とマグネシウム・ニッケル水素化物を組み合わせることで、水素吸蔵・放出の効率的な可逆反応が実現することが見出されました21。


References
- Hydrogen Materials Science and Chemistry of Metal Hydrides, NATO Science Series, v.71. Eds.: M.D.Hampton, D.V.Shur, S.Y.Zaginaichenko, V.I.Trefilov, Kluwer Academic Publishers, Dodrecht, Boston, London, 2002.
- Battery Technology Handbook, 2nd Ed., Ed.: H.A.Kiehne, Expert Verlag GmbH, Renningen-Malsheim, Germany, 2003.
- Material Matters, 2007, Vol. 2 No.2.
- Zaluska, A.; Zaluski, L.; Strom-Olsen, J. O. J. Alloys Compd., 1999, 288, 217.
- Zaluski, L.; Zaluska, A.; Ström-Olsen, J. O. J. Alloys Compd., 1997, 253-254, 70.
- Schimmel,H. G.; Huot, J.; Chapon, L. C.; et al. J. Am. Chem. Soc.,, 2005, 127, 14348.
- Hanada, N.; Ichikawa, T.; Fujii, H.; J. Phys. Chem. B, 2005, 109, 7188.
- Wagemans, R. W. P.; et al. J. Am. Chem. Soc., 2005, 127, 16675.
- Zidan, R. Electrochemical Reversible Formation of Alane. http://www.hydrogen.energy.gov/pdfs/review08/stp_19_zidan.pdf (accessed Oct 24, 2008). Patent application filed.
- Read, C.; Thomas, G.; Ordaz, G.; Satyapal, S. Material Matters, 2007, vol 2, issue 2, 3.
- Graetz,J. ; Wegrzyn,J.; Reilly, J. J. J. Am. Chem. Soc., 2008, 130, 17790.
- Chen, P.; Xiong, Z.; Luo, J.; Lin, J.; Tan, K. L. Nature, 2002, 420, 302.
- David, W. I. F.; Jones, M. O.; Gregory, D. H.; Jewell, C. M.; et al. J. Am. Chem. Soc., 2007, 129, 1594.
- Wu, H. J. Am. Chem. Soc.,, 2008, 130, 6515.
- 米国エネルギー省 水素プログラム
- Johnson, S. R.; Anderson, P. A.; Edwards, P.P.; Gameson,I.; Prendergast, J. W.; Al-Mamouri, M.; Book, D.; Harris, I.R.; Speight, J.D.; Walton, A. Chem. Commun., 2005 2823.
- Sudik, A.; Yang, J.; Halliday, D.; Wolverton, C. J. Phys. Chem. C., 2008 4384 112.
- Z. T. Xiong, C. K. Yong, G. T. Wu, P. Chen, W. Shaw, A. Karkamkar, T. Autrey, M. O. Jones, S. R. Johnson, P. P. Edwards, W. I. F. David, Nat. Mater., 2008 7, 138.
- Wu,Y.; Mohring R.M. Am. Chem. Soc., Div. Fuel Chem. Preprints, 2003 48, 940.
- Anne A Staubitz et al., Chemical Reviews, 2010, 110, 4079.
- Bergemann N., et al., J. Mater. Chem. A, 2018, 6, 17929.
関連情報
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?