ホモベンゾテトラミゾール(HBTM):不斉アシル化のための有機触媒
はじめに
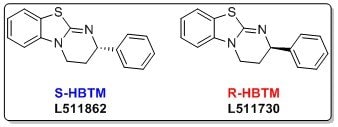
イソチオ尿素系有機触媒であるホモベンゾテトラミゾール(HBTM:homobenzotetramisole)の(R),(S)-エナンチオマー(R-HBTM(L511730)、S-HBTM(L511862))は、少量でさまざまな官能基のエナンチオ選択的転換反応や速度論的光学分割を可能とする触媒として利用が広がっています。
主な利用例
速度論的光学分割
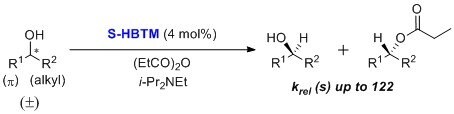
S-HBTM(L511862)はBirmanらによって独自に開発され、酵素法の代替として第2級アルコールの速度論的光学分割に利用されていました1。s-factor = 122と高い値が報告されています。HBTM触媒は、さまざまな有機溶媒と温度範囲でアリル、プロパルギル、ベンジルの第2級アルコールの速度論的光学分割に使用されており、反応は通常数時間で完了します。最適条件として、0 ~-55℃の低温条件、およびトルエン、クロロホルム、tert-アミルアルコールなどの溶媒が報告されています1,2。
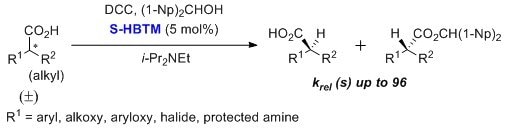
HBTMはα-アリールアルカン酸、α-アリールオキシアルカン酸、α-アルコキシアルカン酸、α-ハロアルカン酸、保護α-アミノ酸の速度論的光学分割に有用です3,4。s-factorの最大値は96と報告されています。通常、トルエン溶媒中、低温、24時間以上の条件で実施されています。
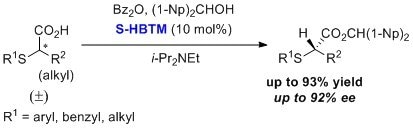
HBTMによるエナンチオ選択的なα-チオアルカン酸生成の速度論的光学分割が報告されています4,5。広範な基質に対して高収率、高エナンチオ選択的に生成物が得られます。
エナンチオ選択的転位反応
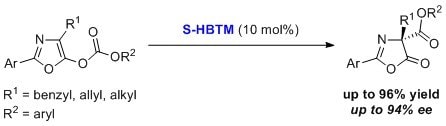
HBTMは炭酸オキサゾリルのカルボキシル基の転位に利用できます6。この反応はさまざまな基質において、通常ジクロロメタン溶媒、低温、16時間の反応条件で高収率、高エナンチオ選択的に進行します。
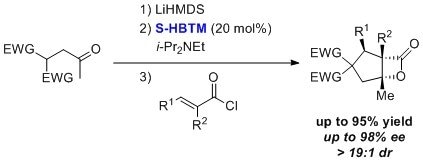
また、HBTMはエナンチオ選択的な求核的マイケル-アルドール-β-ラクトン化(NCMAL)反応にも用いられています7。この反応はTHF/DCM溶媒、24時間以上の条件で高ジアステレオマー比率、高収率、高エナンチオ選択的に進行します。
絶対配置の決定
HBTMは競争的エナンチオ選択的転換(CEC:Competing Enantioselective Conversion)法に有用な触媒であり、立体中心の絶対配置の決定に利用されています。HBTMを用いたCEC法は、第2級アルコールに対して実施され、1H-NMR8とTLC9によって確認されています。なお、TLC分析は学生実験にも利用されています10。この反応は、室温で30分から数時間で進行します。
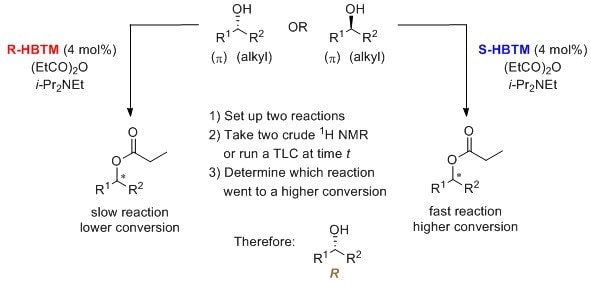
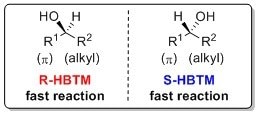
R-HBTM(L511730)とS-HBTM(L511862)触媒による第2級アルコールの絶対配置の相関を示します8-10。
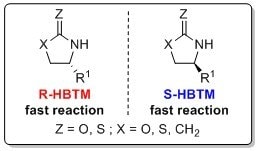
オキサゾリジノン、ラクタム、チオラクタムの絶対配置の決定にも、HBTMによるCEC法が報告されています11。反応は、通常室温から50℃、数時間で完了します。R-HBTM(L511730)とS-HBTM(L511862)触媒によるこれらのシステムの絶対配置の相関を示します。
その他の研究
ベンズヒドリリウムイオンによる実験系で、反応速度定数と平衡定数に基づいたHBTMの求核性およびLewis塩基性の研究が進められています12。さらに、HBTMを触媒とする第2級アルコールのエステル化反応について詳細な速度論的分析が行われ、この転換反応の触媒サイクルが提案されました13。
謝辞寄稿していただいたAlex Wagner、Prof. Scott Rychnovskyの両氏に感謝いたします。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?