
Ganga Panambur, Nicolynn Davis
Sigma-Aldrich Materials Science
MilliporeSigma, Milwaukee, WI USA
Polymeric Drug Delivery Techniques(ドラッグデリバリーにおける高分子科学の手法), 2015, p.24
PNIPAMミセル
PNIPAMブロックを含む両親媒性ポリマーから、温度応答性を持つ薬物担持ミセルを形成することができます1。最も簡単な方法である透析法では、最初に共重合体を希薄濃度で有機溶媒に溶解します(例えば、30 mgのPNIPAM共重合体を5 mLのDMFまたはTHFに溶解します。有機溶媒は共重合体の組成および溶解度に基づいて選択します)。
薬物をカプセル化するためには、透析の前に薬物を有機溶媒に加えます。分画分子量3,500 Daの膜を使用して、この溶液を脱イオン蒸留水に対して、水の交換頻度に応じて最長5日間まで透析します。
PNIPAM共重合体ミセルは別の方法で形成することもできます(「薬物送達用ポリマーミセル」にて、Dr. Du および Dr. Stenzelにより紹介されています)。
PNIPAMとタンパク質のコンジュゲート
例えば、末端にアミン基を持つPNIPAM(724823)はタンパク質のコンジュゲートに使用可能で、チオールとの結合のために、さらに修飾してマレイミド官能基を付与することもできます2。チオールを利用したコンジュゲート法では、PNIPAM-アミンがPNIPAM-Malに変換されたあと、タンパク質治療薬にコンジュゲートします(図1)。
- PNIPAM-Malの合成
アミノ末端基がスクシンイミジル4-(N-マレイミドメチル)シクロヘキサン-1-カルボキシラート(M5525)とジクロロメタン中で1:1.5の比率で反応し、PNIPAM-Malが生成します。不溶物をろ過したあと、15倍の過剰量のジエチルエーテル中で沈殿させて生成物を分離・精製します。
- タンパク質のコンジュゲート
A) タンパク質溶液の調製:適当な水性緩衝液にタンパク質を溶解し(例えば、1 mMのタンパク質を50 mMリン酸塩、1 mM EDTA緩衝液に溶解、pH 8.0)、4℃で10分間、1 mMのジチオスレイトール(DTT、D9779)を使用してチオールを還元します。スピンフィルターまたは用いた緩衝液と十分に平衡に達したSephadex® G-25ゲルろ過カラムにこの溶液を通してDTTを除去します。
B) タンパク質のコンジュゲート:手順2aで得られたタンパク質溶液と手順1で精製したPNIPAM-Malを、モル過剰量(推奨10倍)のPNIPAM-Malを使用して混合します。室温で4時間、軽く振とうしながら反応を進行させます。得られたタンパク質-PNIPAMコンジュゲートは、10% (v/v) 飽和(NH4)2SO4を用いて、溶液を37℃に加熱、沈殿させることで精製できます。沈殿物を10,000 x gで遠心処理して分離します。
注記:タンパク質の性質に応じて、カラムクロマトグラフィーなどの他の方法でも精製を行うことができます。
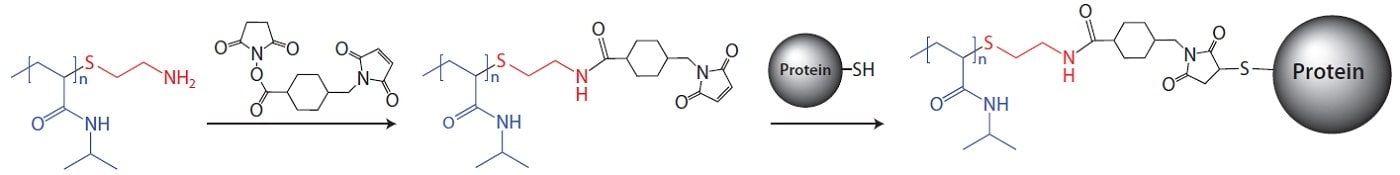
図1 PNIPAMマレイミドとタンパク質フリーのチオールとのコンジュゲートの概略図
PNIPAM共重合体で被覆したリポソームの調製
熱応答性およびpH応答性PNIPAMポリマーでリポソームを被覆することで、刺激応答性の薬物送達担体を作製することができます3。例えば、図2に示すポリ(N-イソプロピルアクリルアミドコオクタデシルアクリレート)(724475)は、疎水性のオクタデシル側鎖をポリマー鎖に沿ってランダムに含んでいます。酸基がポリマーにpH応答性を与え、オクタデシル鎖はリポソーム脂質二重層への固定化に寄与します。
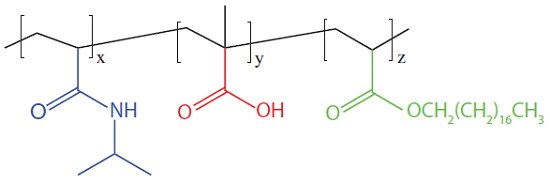
図2 ポリ(N-イソプロピルアクリルアミドコオクタデシルアクリレート)の構造
一般的な方法として、脂質を水和したあと押出しによってリポソームを最初に調製し、再水和の段階でPNIPAM共重合体を加えます。リポソームの調製は、ベシクルの形成、ベシクルの粒径調整、精製の3段階で行います。最も多用されているリポソームの調製法は、脂質の水和や、逆相蒸発法や有機溶媒注入法による有機溶媒交換があります。
リポソームの調製
- 1-パルミトイル-2-オレオイル-sn-グリセロ-3-ホスホコリン(POPC、42773)とコレステロール(C8667)の脂質混合物20 mg(3:2 mol/mol)を、100 mLのフラスコ内でクロロホルム10 mLに溶解します。脂質混合物が溶解したあと、ロータリーエバポレーターを使用して減圧下、35℃でクロロホルムを除去します。残留している微量のクロロホルムを除去するため、溶媒を除去したあと高真空下で少なくともさらに2時間、ロータリーエバポレーターで蒸発を続けます。これにより、フラスコの内壁に乾燥した脂質薄膜が形成されます。
- 薬物担持リポソームの調製
- 親水性分子の場合:
- 適当な水性緩衝液に薬物を溶解します。
- 乾燥した脂質薄膜に5~10 mLの薬物溶液を加えて水和します。フラスコを密封し、3~5分間超音波処理して脂質-薬物エマルションを形成します。
- 疎水性薬物の場合:
- 最少量(5~10 mL)の適当な有機溶媒(ジエチルエーテルのような低沸点溶媒が望ましい)に薬物を溶解します。薬物を完全に溶解させます。
- 手順1で得られた乾燥した脂質薄膜に薬物溶液を加え、超音波処理してよく混合します。
- この脂質–薬物溶液に、5 mLシリンジを使用して1 mLの水溶液(例:150 mM NaCl、0.02% w/w NaN3または他の適当な緩衝液)を急速に注入します。
- フラスコを密封し、3分間超音波処理して脂質-薬物エマルションを形成します。
- 粘性のゲル層が形成されるまで、真空下、37℃でロータリーエバポレーターを使用して有機溶媒を除去します。
- ボルテックスミキサーを使用してゲルをよく撹拌し、LUV(Large Unilamellar Vesicle:大型単層小胞)懸濁液に変換します。
- 親水性分子の場合:
- サイズ調整:リポソームのサイズは、孔径0.2 μmのポリカーボネート膜を使用した押出しろ過システム(LiposoFast)で調整することができます。異なる孔径の膜を使用して、要求されるサイズ範囲のリポソームを得ることができます。押出しのあと、ゲルろ過(例えば、上記のリポソーム調製段階で使用した水性緩衝液と平衡に達しているSephadex® G-100ゲルカラムを使用)またはスピンカラムによって、カプセル化されていない薬物を除去します。
- PNIPAMで被覆したリポソームの作製:
- 150 mMのNaClおよび0.02% w/w NaN3(またはリポソームの再水和に適した他の水性緩衝液)中で、PNIPAM(724475)の6 mg/mLの原液を調製します。
- PNIPAM溶液を、手順3で得られた薬物担体リポソーム溶液に加えます。
- PNIPAMで被覆したリポソームは4℃の水性緩衝液中で保存可能で、凍結乾燥して保存することもできます。
References
- Smith, A. E.; Xu, X.; McCormick, C. L. Prog. Polym. Sci. 2010, 35, 45.
- Chilkoti, A.; Chen, G.; Stayton, P. S.; Hoffman, A. S. Bioconjugate Chem. 1994, 5, 504.
- Francis, M. F.; Dhara, G.; Winnik, F. M.; Leroux, J-C. Biomacromolecules 2001, 2, 741.
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?