Alice Du, Martina Stenzel
Centre for Advanced Macromolecular Design, School of Chemistry, University of New South Wales, Australia
Polymeric Drug Delivery Techniques(ドラッグデリバリーにおける高分子科学の手法), 2015, p.3
はじめに
両親媒性ブロック共重合体の自己集合により得られるポリマー系ミセルは、ポリマー系ナノ粒子の中でおそらく最もよく使用されている薬物送達担体の1つでしょう1–4。特にATRP5やRAFT6などの高度に制御された重合法の出現により、生物医学用途に適した新しい種類のブロック共重合体が急激に増加しています。また、ポリマー構造を容易に制御できるということは、ミセル、円筒状ミセル、ポリマーソームなど、非常に多数の自己集合体の形態を実現できることも意味しています。ミセルは、特に薬物担体としての可能性に注目が集まっています。これは、コア-シェル型構造を取るために、疎水性薬物に適した疎水性のコアをもちながらも高い水溶性を示すためです。多くの薬物は水に不溶であるため、この特性は薬物送達にとって非常に重要であり、薬物を担体へ充填することで、その溶解度を数桁増加させることできます4,7。
ブロック共重合体の選択
薬物担体の選択は非常に困難に見えるかもしれません。市販されているブロック共重合体の種類の多さに加えて、ポリマー設計の進歩を受けて両親媒性構造の設計には基本的に限界がありません。ブロック共重合体は、他の両親媒性ポリマー(ミクトアーム星型ポリマー、マルチブロック共重合体、星型ポリマーなど)でさらに補完することで、コンパートメント化ミセルを形成することが可能です。どの構造を選択した場合でも、薬物とポリマーの混和性を第一に考慮するべきです7。ポリマーと薬物の相互作用は、担体の薬物担持容量やマトリックス内の薬物の安定性を左右する重要な要素であり、最終的には担体の貯蔵安定性に影響します。薬物とポリマー系マトリックスの相溶性は、Flory–Huggins理論によって説明できます。この相溶性は、エントロピー成分とエンタルピー成分の双方を含み、ポリマーと薬物の間の相互作用を示すFlory–Huggins相互作用パラメータχを用いて表されます。言い換えると、Flory–Hugginsパラメータχはポリマーと薬物の混和性の尺度です。
多くの薬物は結晶化する傾向が強いため、ポリマーと薬物の相互作用の理論的モデルではこれを溶液のように扱い、均一な混合物の存在は分子レベルの溶液の相図の相溶曲線によって決定されます。さらに、この2成分系の熱力学的安定性を議論するモデルは、速い平衡に基づいています。ただし、Tgが高いポリマーは薬物をマトリックス内に捕捉して、速度論的に安定な系になる場合があるため、必ずしも速い平衡は成立しません。基礎となる熱力学的な理論に関心がある場合は、非常に優れた総説論文8がありますので、こちらをご参照ください。
それでは、十分な担持容量と高い安定性を実現するためには、適切な薬物とポリマーをどのように選択すればいいでしょうか。出発点として、「似た者同士は溶解する」という仮定を設定するのが良いでしょう。この経験則は、式1のFlory–Hugginsパラメータχに基づいています。
ここで、δsおよびδpはそれぞれ溶質およびポリマーのScatchard–Hildebrand溶解度パラメータです7。要約すると、薬物と化学的に類似したポリマーを用いると担持容量を最大化できます。良い例として、ポリマーにコンジュゲーションしたドキソルビシンが挙げられます9。ポリマーに付着したドキソルビシンは不活性であることが判明していますが、このようなポリマー-薬物コンジュゲートで形成されたポリマーミセルは、遊離ドキソルビシンに対する適合性が最大限に高まった環境を作り、担持容量が増加しました。充填するものと同じ薬物でポリマーを修飾することは効果的な方法ではあるものの、コストが非常に高くなります。別の方法として、ポリマーの置換基を変えて内側のポリマー構造を微妙に変化させることで、担持容量を最大化することも可能です。例えば、選択された薬物に対して担持容量が可能な限り最大になるようにポリマーマトリックスの疎水性を調節する目的で、PEO-b-PCLポリマーがベンジル基、カルボキシ基、ステアリル基、パルミトイル基、コレステリル基で修飾されています10。
ただし、薬物に適した薬物担体を綿密に調整できる合成化学者は、どこの研究室にもいるわけではありません。そのため、薬物に対して可能な限り最適なポリマー構造を予測するツールが必要となります。これは容易ではありませんが、最初の見積もりとしては、近似的な部分溶解度パラメータを決定するための原子団寄与法を用いることができます。この方法では、ポリマーと薬物をそれぞれ基本構造となる官能基に分割し、それらを用いてポリマーと薬物の分散力、双極子-双極子相互作用、水素結合を決定します11。この方法は最適なポリマー系薬物担体の予測に頻繁に採用されていますが12–13、多くの観点が考慮されていないため不適切な予測が得られることにも注意する必要があります。水素結合の重要な役割を明らかにすることが可能な分子動力学シミュレーションに基づけば、より良い予測をすることもできます14。これは、大きな薬物担持容量を実現するためには、疎水性相互作用より水素結合が重要になる場合もよくあるためです15。さらに、自由エネルギーモデルに基づいた理論では、低分子量化合物のミセルへの可溶化が説明できます。これらの情報に基づき、ミセル内の薬物の分布、凝集数、ミセルのサイズ、ミセルの安定性に対する影響、可溶化の最大限度について結論を導くことが可能です16。多様な計算法の要約がAllenらの総説論文に紹介されています17。
【プロトコール】ミセルへの薬物の充填方法
適切なポリマーを決めた後に、薬物をミセルに充填します7,18。疎水性の薬物とミセルを水中で直接混合する方法は、一部の限られた系には適していますが、薬物とポリマーの双方を溶解することが可能な場合はまれです。したがって、薬物とポリマーの双方を確実に可溶化する別の方法を用いる必要があります。薬物とブロック共重合体の双方に共通する溶媒を用いれば、ユニマー状態(単一のブロック共重合体)として完全に溶解させることが可能です。溶液が透明であることは、ポリマーが溶解したことを示す第一の指標となりますが、完全に溶解したことを確認するためには、光散乱法を用いてミセルやその他の凝集体が存在しないことを検査するのが望ましいです。一般的な薬物充填方法の例を以下に示します。
溶媒蒸発法
溶媒蒸発法では、ポリマーと薬物を低沸点の有機溶媒に溶解し、溶媒を蒸発した後、水に溶解させます19。選ばれた有機溶媒は1つのブロックに対して選択的であるため、非水溶液中でミセルが形成します。通常、溶媒の種類、ポリマーおよび薬物の濃度、蒸発の速度によって結果が決まります。この方法の制限として、溶媒の選択肢が限られていること、および水に容易に再溶解することが可能で明確に制御されたコア-シェル型構造の粒子が得られるとは限らないことがあげられます。
方法例
- 2 mgの薬物と20 mgのポリマーをメタノール(または両成分を溶解可能な低沸点の他の溶媒)に溶解します。
- 減圧下で溶媒を蒸発します。
- 蒸留水を加え、10分間40℃でインキュベーションし、ボルテックスすると、透明な溶液が得られます。

A) ポリマーと薬物を有機溶媒に溶解する。B) 減圧下で有機溶媒を蒸発させる。C) 蒸留水で溶解する。
共溶媒蒸発法
共溶媒蒸発法は、水を有機溶媒に直接加えることで、ミセルの自己集合および薬物のカプセル化を引き起こす方法です。結果の制御は、溶媒の種類、有機溶媒と水の比率、水および薬物の濃度、溶媒の蒸発速度、混合の順序および速度によって行われます20。この方法では溶媒の選択肢が限られていますが、一般に高効率で薬物をカプセル化できます。
方法例
- 20 mgのポリマーと2 mgの薬物を1 mLのアセトン、THF、またはアセトニトリルに溶解します。
- 2 mLの水を有機溶媒に滴下して加えます(またはその逆)。
- 4時間混合した後、有機溶媒を蒸発させます。

A) ポリマーと薬物を有機溶媒に溶解する。B) 溶媒に水を滴下、またはその逆を行う。C) 有機溶媒を蒸発させる。
透析
透析は、DMSOのような高沸点溶媒の使用が可能になるため、薬物をカプセル化する方法としておそらく最も汎用性に優れ、広く用いられている方法です。透析によって溶媒を除去して水と交換できます。この方法は多くの溶媒系に適用可能ですが、共溶媒蒸発法と比較すると薬物の担持効率は通常低く、長い時間が必要になる場合があります。この工程は遅いため、熱力学的に安定な形状を形成させるのに有利です。薬物担持量を最大限に維持しながら有機溶媒が含まれない生成物を得るためには、溶媒と担持されていない薬物を除去するための最終なさらなる透析が、必要となることもよくあります。ただし、十分に透析することにより完全に生成物を精製することも可能な一方、すでにカプセル化されている薬物の放出も同時に引き起こしてしまい、薬物のカプセル化効率が低下してしまう場合もあります。
方法例
- 20 mgのポリマーと2 mgの薬物を1 mLのDMFに溶解します。
- 5 mLの水をゆっくりと加えます。可能であれば、シリンジポンプを使用して、水を加える速度を制御します。
- チューブ状のセルロース膜を使用して、水中で透析します。
A, B) 有機溶媒に溶解したポリマーと薬物にゆっくり水を加える。C, D) 透析により有機溶媒を除去する。
フラッシュナノ沈殿法
フラッシュナノ沈殿法は、他の長時間かかってしまう方法よりも素早く行うことができる比較的新しい方法です。薬物および1つのポリマーブロックに対する非溶媒中で急速に混合および沈殿させることで、速度論的に束縛された構造が得られます。熱力学的に安定な構造とは異なり、得られる構造内部の相の境界は明確に制御されませんが、この方法はハイスループットでの作製を実現できる代替法です21。
方法例
- 40 mgのポリマーと20 mgの薬物を1 mLのTHF溶液に調製します。
- 拘束衝突噴流ミキサー(confined impinging jet mixer)を使用して、溶液を1 mLの水と混合します。
- 出口流を8 mLの水:THF(9:1 v/v%)に導入します。
- チューブ状のセルロース膜を使用して、水中で透析します。
A) 拘束衝突噴流ミキサーを用いて2層を急速に混合する。B, C) 透析により有機溶媒を除去する。
特性評価
薬物が充填されたミセルの特性は、方法によらず他のナノ粒子と同様に評価できます。特に注目すべきパラメータは、薬物カプセル化効率(EE)と薬物担持容量(LC)です(式2を参照)。
ここで、WLは充填した薬物の重量、W0は最初に加えた薬物の量、WNはナノ粒子の重量です。
国際標準化機構(ISO)により、ナノ粒子の詳細にわたる評価に向けた特性に関するカタログが発行されています。このカタログ「Guidance on Physico-chemical Characterization of Engineered Nanoscale Materials for Toxicologic Assessment」(ISO/TR 13014:2012)では、寸法、形状、比表面積、表面電荷、組成、純度などの様々な特性が示されています。これらの特性の多くはミセルの評価にも適用でき、薬物送達用ミセルの評価にあたっては、ミセルの安定性が非常に重要な指標となることが多くあります。ミセルの動的挙動は、ミセルの細胞取込み22やエキソサイトーシスの速度23に影響を与える可能性があることが示されています。そして、ナノ粒子の物理化学的特性評価は、「Compilation and Description of Toxicological Screening Methods for Manufactured Nanomaterials」(ISO/TR 16197:2014)で補完されており、毒性、蓄積、その他の要素を理解するために推奨される実験のリストが提供されています。このトピックについては、背景や実践的な助言も提供している包括的な出版物があるので、参照してください24,25。
多細胞スフェロイドは、確立された薬物送達の方法であり、薬物が充填されたミセルの試験を含むナノ医薬品領域に進出しています26–28。興味深いことに、薬物が充填されたミセルの一部では、単層の細胞モデルでは成績が良くないものの、3次元(3D)の細胞培養実験では顕著に結果が異なる場合があります26。このような振舞いの鍵となるのは、多細胞スフェロイドへの薬物およびミセルの浸透の差異です。この観点は、2次元(2D)モデルにおいて果たす役割は小さいものの、3D環境では送達効率の向上を理解するために重要なパラメータの1つになります29。これらの3Dモデルは、さらに2Dモデルと組み合わせることで、腫瘍の微小環境を模倣してin vivoでのミセルの挙動をシミュレーションするための精巧なシステムを作ることが可能です30。薬物が充填されたミセルの毒性を試験するための典型的な手順の概要を以下に示します。スフェロイドの培養には多様な方法を選択することが可能ですが31、ここでは「ハンギングドロップ」法のみを紹介します。ハンギングドロップ法は、特殊な装置を使用することなく、比較的均等な一連のスフェロイドを作製する簡便な方法です。
【プロトコール】スフェロイドを用いた毒性の評価
ハンギングドロップ法でスフェロイドを培養する場合の典型的な手順を以下に示します。
- 各スフェロイドに対して必要な播種する細胞数(通常、1,000~2,000細胞/スフェロイド)を予め決定します。
- 細胞培養に使用する増殖培地で、最初に播種する細胞数より1 mLあたりの濃度が100倍の細胞懸濁液を調製します。
- 10 µLの細胞懸濁液を十分に混合し、シャーレの蓋の内側の表面に置きます。
- 播種に必要な数の液滴を配置するまで繰り返します。
- 播種する液滴が「垂れ下がる」ようにシャーレの蓋を裏返し、15 mLの滅菌PBSが入ったシャーレの上に配置します。
- シャーレを動かさずに、37℃および5%のCO2で最低3日間インキュベーションします。
- スフェロイドが求めるサイズ(通常は直径300~400 µm)に達するまで毎日確認します。
- 培養が完了したら、1ウェルあたり200 µLの培地が入った96ウェルプレートにスフェロイドを移動します。
- 37℃および5%のCO2でスフェロイドをもう1日間培養します。この間、4ウェイミキサーの上でプレートをゆっくり回転します。
求める形状およびサイズにスフェロイドが培養されたら、ミセル製剤を充填して試験を行うことが可能になります。
- スフェロイドを含む96ウェルプレートの各ウェルから170 µLの培地を取り除きます。
- 100 µLの2倍濃縮の細胞培地と100 µLの2倍濃縮のミセル溶液を各ウェルに加えます。
- 37℃および5%のCO2で任意の時間インキュベーションします。
- 任意の時点で、試験するスフェロイドを新しいプレートに移動してPBSで洗浄します。
- スフェロイドの生存性を、DNA量の決定や酸性ホスファターゼ活性の測定などのなんらかの方法で測定します32。
スフェロイドの培養に関するその他のこつを以下に記載します。
- 最初に液滴をシャーレの蓋に置くときは、表面張力を利用して液滴の形状を自然に維持します。
- 培養の際に液滴が若干拡がる余裕をもたせるため、液滴は1 cm以上の間隔で配置します。
- 形状やサイズが望みどおりでないスフェロイドが含まれる場合に備えて、必要な量より少なくとも25%多くスフェロイドを調製します。
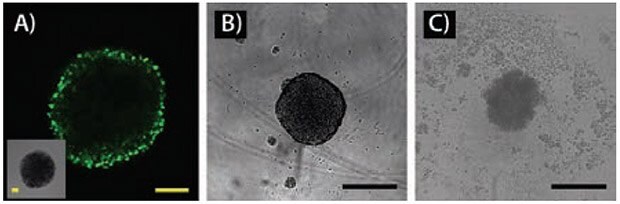
図2A)架橋していない蛍光性ミセルの前立腺がん(LNCaP)スフェロイドへの浸透。共焦点顕微鏡法を用いて深さ90 µmで可視化(黄色のスケールバー = 100 µm)。B)培養4日後のLNCaPスフェロイド(黒のスケールバー = 300 µm)。C)パクリタキセルとコンジュゲーションされた架橋していないミセルで処理した14日後のLNCaPスフェロイド。
結論
現在、ポリマーミセルを使用した薬物の送達は、十分に確立された分野に成熟しています。薬物とポリマーの間の適合性が、担持効率を最大化するための鍵となります。薬物を充填するためのツールには幅広い選択肢があります。本稿で述べた方法で多くの薬物を充填することが可能ですが、担持効率が低い薬物などの一部の薬物の場合には、物理的な引力のみに依存するのではなく、薬物をブロック共重合体に直接コンジュゲーションすることで最も効率よく送達できます。また、本稿ではミセルの架橋の利点に触れていないことにも注意してください2,33。簡単には示しましたが、ミセルは動的で、また分解し得るため、生物学的物質との相互作用に影響を及ぼしてしまうことがあります。架橋は細胞取込み22,23、多細胞性腫瘍内の移動29、in vivoでの循環33などが向上し得るため、架橋によりこれらの問題を回避できる可能性があります。まとめると、ポリマーミセルは、その修飾方法は無限にあると言え、多様な薬物を送達することができる汎用性に優れた手段です。
本論文の翻訳は山形大学 落合文吾教授に監修いただきました。御礼申し上げます。
掲載誌
「ドラッグデリバリーにおける高分子科学の手法 Polymeric Drug Delivery Techniques」
まとめてご覧になりたい方のためにPDFをご用意しています。
関連製品
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?