おすすめの製品
由来生物
mouse
品質水準
抗体製品の状態
purified immunoglobulin
抗体製品タイプ
primary antibodies
クローン
3F4, monoclonal
化学種の反応性
hamster, human
メーカー/製品名
Chemicon®
テクニック
ELISA: suitable
immunohistochemistry (formalin-fixed, paraffin-embedded sections): suitable
immunoprecipitation (IP): suitable
western blot: suitable
アイソタイプ
IgG2a
NCBIアクセッション番号
UniProtアクセッション番号
輸送温度
dry ice
ターゲットの翻訳後修飾
unmodified
遺伝子情報
human ... PRNP(5621)
詳細
プリオンは多種多様な哺乳類動物において多数の疾病を引き起こすと考えられており、このような疾病には畜牛の牛海綿状脳症(BSE、「狂牛病」としても知られている)、ヒトのクロイツフェルト・ヤコブ病(CJD)などが含まれます。これまでプリオン起源と仮定されている疾病は脳または他の神経組織の構造に変異をもたらし、これらすべての疾病は現在のところ治癒方法がなく最終的に死に至ります。仮説によれば、プリオンは感染して伝搬するにつれて構造の異常なリフォールディングを引き起こし、正常なタンパク質分子を異常な構造形態へと変化させます。現在までに知られているすべてのプリオンはアミロイドフォルド(折り畳み構造)を形成し、このフォルド内のタンパク質が重合して密に詰め込まれたベータシートの集合体となります。このようにして変異した構造は極めて安定であるとともに、感染した組織をさらに取り込むため、細胞の死と組織の損傷を引き起こします。この安定性は、プリオンが化学的、物理的エージェントによる変性に対する抵抗を意味し、このような粒子の除去や閉じ込めを困難にしています。
特異性
プリオンタンパク質、ヒト、ハムスター、ネコ科の109~112アミノ酸残基。他の哺乳類種由来のPrPとは反応しません。MAB1562は天然PrPおよび変性型PrPと反応します。固定された組織と細胞については、エピトープを再曝露させる必要があります(下の説明参照)。プロテアーゼ感受性、およびプロテアーゼ耐性の両方の形態のPrPを認識します。
免疫原
エピトープ:a.a. 109-112
アプリケーション
Anti-Prion Protein Antibody、a.a.109-112、clone 3F4は、プリオンタンパク質検出用としてELISA、IH、IH(P)、IP、WBでの使用が検証されています。
免疫組織染色(パラフィン):
前ロットの代表的な画像。 クエン酸バッファーで最適染色、pH 6.0、エピトープ修復:ヒト脳
の免疫組織染色(Kitamoto et al., 1987):
1:100-1:1,000 *以下のプロトコル参照。
以下のいずれかの手順を用いて組織を前処理することにより、固定組織のエピトープを再曝露する必要があります:
a. 室温においてギ酸で10分間(Kitamoto et al., 1987)
b. 加水分解オートクレーブ処理(Kitamoto et al., 1991)
c. 電子レンジ処理(BioGenex, San Ramon, CA)
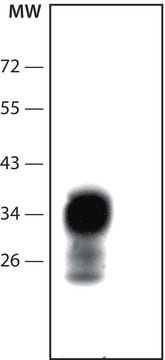
ウェスタンブロット: (Kascsak, R.J., 1991; Kascsak, R.J., 1987):
前回のロットを1:10,000-1:100,000希釈で使用しました。
免疫沈降:(Kascsak, R.J., 1991; Kascsak, R.J., 1987):
前回のロットを1:10-1:100希釈で使用しました。
ELISA:(Kascsak, R.J., 1991; Kascsak, R.J., 1987):
1:100,000希釈の前回のロットを使用しました。
最適な希釈濃度は、ご自身で決定してください。
前ロットの代表的な画像。 クエン酸バッファーで最適染色、pH 6.0、エピトープ修復:ヒト脳
の免疫組織染色(Kitamoto et al., 1987):
1:100-1:1,000 *以下のプロトコル参照。
以下のいずれかの手順を用いて組織を前処理することにより、固定組織のエピトープを再曝露する必要があります:
a. 室温においてギ酸で10分間(Kitamoto et al., 1987)
b. 加水分解オートクレーブ処理(Kitamoto et al., 1991)
c. 電子レンジ処理(BioGenex, San Ramon, CA)
ウェスタンブロット: (Kascsak, R.J., 1991; Kascsak, R.J., 1987):
前回のロットを1:10,000-1:100,000希釈で使用しました。
免疫沈降:(Kascsak, R.J., 1991; Kascsak, R.J., 1987):
前回のロットを1:10-1:100希釈で使用しました。
ELISA:(Kascsak, R.J., 1991; Kascsak, R.J., 1987):
1:100,000希釈の前回のロットを使用しました。
最適な希釈濃度は、ご自身で決定してください。
品質
免疫組織染色(パラフィン):
プリオンタンパク質(カタログ番号:MAB1562)正常な脳における染色パターン/形態。組織をクエン酸、pH 6.0で前処理しました。この抗体を、IHC-Select Detection with HRP-DABを用いて1:500に希釈しました。免疫反応性は主としてニューロンの細胞体を染色するときに見られます。
クエン酸バッファー、pH 6.0を用いた最適染色、エピトープ修復:ヒト脳
プリオンタンパク質(カタログ番号:MAB1562)正常な脳における染色パターン/形態。組織をクエン酸、pH 6.0で前処理しました。この抗体を、IHC-Select Detection with HRP-DABを用いて1:500に希釈しました。免疫反応性は主としてニューロンの細胞体を染色するときに見られます。
クエン酸バッファー、pH 6.0を用いた最適染色、エピトープ修復:ヒト脳
ターゲットの説明
12.3 kDa
物理的形状
フォーマット:精製
保存剤は含まないPBSを含むバッファー中の精製マウスモノクロナールIgG2a。
法的情報
CHEMICON is a registered trademark of Merck KGaA, Darmstadt, Germany
Not finding the right product?
Try our 製品選択ツール.
保管分類コード
12 - Non Combustible Liquids
WGK
WGK 2
引火点(°F)
Not applicable
引火点(℃)
Not applicable
適用法令
試験研究用途を考慮した関連法令を主に挙げております。化学物質以外については、一部の情報のみ提供しています。 製品を安全かつ合法的に使用することは、使用者の義務です。最新情報により修正される場合があります。WEBの反映には時間を要することがあるため、適宜SDSをご参照ください。
Jan Code
MAB1562:
試験成績書(COA)
製品のロット番号・バッチ番号を入力して、試験成績書(COA) を検索できます。ロット番号・バッチ番号は、製品ラベルに「Lot」または「Batch」に続いて記載されています。
Jacob I Ayers et al.
PLoS pathogens, 7(3), e1001317-e1001317 (2011-03-26)
Prion strains are characterized by differences in the outcome of disease, most notably incubation period and neuropathological features. While it is established that the disease specific isoform of the prion protein, PrP(Sc), is an essential component of the infectious agent
Qi Shi et al.
International journal of molecular medicine, 41(4), 2413-2419 (2018-02-03)
Normal prion protein (PrP) contains two cysteines at amino acids 179 and 214, which may form intra‑ and interpeptide disulfide bonds. To determine the possible effects of this disulfide bridge on the biochemical features of PrP, prokaryotic recombinant human wild‑type PrP
Zuzana Krejciova et al.
The Journal of experimental medicine, 214(12), 3481-3495 (2017-11-17)
Prions are infectious agents that cause neurodegenerative diseases such as Creutzfeldt-Jakob disease (CJD). The absence of a human cell culture model that replicates human prions has hampered prion disease research for decades. In this paper, we show that astrocytes derived
Michele Christine Landemberger et al.
Journal of neurochemistry, 145(5), 409-416 (2018-01-18)
Cellular prion protein (PrPC ) is widely expressed and displays a variety of well-described functions in the central nervous system (CNS). Mutations of the PRNP gene are known to promote genetic human spongiform encephalopathies, but the components of gain- or
Anthony E Kincaid et al.
Journal of virology, 86(23), 12731-12740 (2012-09-14)
Prion infection and pathogenesis are dependent on the agent crossing an epithelial barrier to gain access to the recipient nervous system. Several routes of infection have been identified, but the mechanism(s) and timing of in vivo prion transport across an
ライフサイエンス、有機合成、材料科学、クロマトグラフィー、分析など、あらゆる分野の研究に経験のあるメンバーがおります。.
製品に関するお問い合わせはこちら(テクニカルサービス)