NanoFabTx™: Mikrofluidní platforma pro mRNA vakcíny
Ben Knappett1, Richard Gray1, Zhen Ye2, Rajiv Kumar2, Elizabeth Aisenbrey2, Nicolynn Davis2
1Dolomite Microfluidics, 2Merck
Pandemie COVID-19 výrazně urychlila výzkum vakcín, v jehož čele stála mRNA. Aby byly mRNA vakcíny účinné, je nezbytný nosič, který dokáže dopravit vakcínu na cílové místo a chránit mRNA před rychlou degradací v těle. Tento požadavek vedl k vývoji mnoha nosičů na bázi lipidů, známých také jako lipidové nanočástice (LNP) nebo liposomy. Zatímco konvenční výroba nosičů na bázi lipidů zahrnuje zdlouhavou optimalizaci metodou pokus-omyl, alternativní přístupy využívající mikrofluidiku mohou zefektivnit vývoj vakcín v rané fázi. Naše Sady NanoFabTx™ s činidly a mikrofluidními zařízeními poskytují platformu připravenou k použití pro screening více formulací a nakonec pro syntézu lipozomů s mRNA nebo léčivem pro předklinické hodnocení.

Obrázek 1. Vakcíny COVID-19 v klinickém vývoji, WHO, 29. října 2021.Celosvětová poptávka po vakcínách rychle roste, přičemž v relativně normálních dobách dochází k nárůstu počtu dávek o více než 25 % ročně (WHO, 2019). Nástup nových virů, jako je Ebola, MERS, SARS a současná pandemie COVID-19, vede k dramatickému nárůstu poptávky a silnému tlaku na zkrácení vývoje. Na konci října 2021 tvořily RNA vakcíny 17 % vakcín COVID-19 v klinickém vývoji (WHO).
Co jsou to mRNA vakcíny?
Na rozdíl od tradičních vakcín, které často používají oslabenou nebo usmrcenou formu patogenu, nesou chemicky syntetizované mRNA (neboli messenger RNA) vakcíny pouze tolik informací, aby naučily naše buňky vytvořit malou část patogenu. Jakmile naše buňky fragment patogenu vyrobí, náš imunitní systém rozpozná, že k němu nepatří, a spustí imunitní reakci, která nás ochrání před budoucí infekcí. Z vakcíny mRNA není možné, aby naše buňky vytvořily celý patogen, což zvyšuje bezpečnost.
Navíc bylo zjištěno, že vakcíny mRNA vytvářejí spolehlivou imunitní odpověď a jsou dobře snášeny zdravými jedinci s malým počtem vedlejších účinků. Vzhledem k tomu, že vakcíny mRNA lze vytvořit v laboratoři a nevyžadují buněčnou kulturu, je jejich výroba rychlejší a standardizovanější, což může potenciálně zlepšit reakci na vznikající epidemie.
RNA je křehká molekula a ve volném stavu by se v těle rozložila přirozenými enzymatickými procesy. Úspěšné dodání mRNA do buněk je proto klíčovou výzvou při vývoji mRNA vakcín. Zapouzdření mRNA do lipidových nosičů (liposomů a LNP) je ideálním způsobem, jak zajistit, aby se mRNA vakcína úspěšně dostala do buněk a byla doručena do cytoplazmy (obrázek 2).
podávání vakcín s mRNA prostřednictvím lipidových nosičů
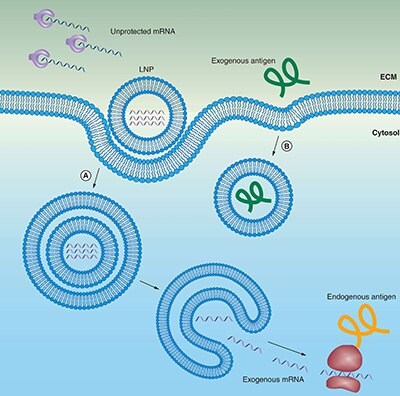
Obrázek 2.Lipidové nosiče (liposomy) chrání mRNA před degradací a usnadňují endocytózu a endosomální únik.
(A) mRNA může být zapouzdřena do liposomů pro ochranu před enzymatickou degradací. Pozitivně nabité liposomy upřednostňují lokalizaci mRNA na negativně nabité buněčné membráně, včetně následné endocytózy do cytosolu. Aby se mRNA dostala do cytoplazmy a mohla být přepsána, musí uniknout jak z endozomu, tak z lipidového nosiče.
(B) Vakcíny na bázi extracelulárních proteinů jsou endocytovány podobným způsobem, ale nemusí uniknout z endozomu, aby byly prezentovány na MHCII.
Vlastnosti lipidových nosičů:
- Lipid nanocarriers closely resemble the structure of cell membranes
- They can be used to deliver both hydrophobic and hydrophilic drugs
- Jejich přirozené složení a nanorozměry jim umožňují být účinnými nosiči, které se dostanou do vnitřních tkání a buněk a uloží do nich účinné léčivé látky, nukleové kyseliny, proteiny, kmeny DNA nebo RNA b>
- Díky povrchovému zdobení ligandy a/nebo společnému doručení s adjuvanty mohou lipidové nosiče cílit na požadované typy buněk
Výběr lipidů je klíčovým faktorem pro doručování mRNA a vyžaduje řadu kroků k optimalizaci specifického složení lipidů, jejich velikosti, stability, náboje, funkcionalizace povrchu, jakož i účinnosti zapouzdření a uvolňování mRNA. Vakcíny založené na lipidech mRNA společností Moderna a Pfizer ukazují význam této technologie v epidemiologickém boji proti onemocnění COVID-19.
Mikrofluidika pro zefektivnění a vysoce výkonnou optimalizaci lipidů
Konvenčně se lipidové nosiče vyráběly dávkovými metodami (obrázek 3B), pomalým přidáváním roztoku lipidů do míchané vodné fáze. Tento přístup poskytuje špatnou kontrolu velikosti výsledných LNP, nízkou účinnost enkapsulace a vyžaduje revalidaci pokaždé, když se proces škáluje z laboratoře do pilotního závodu na plnou výrobu. Mikrofluidní metody (obrázek 3A) mohou pomoci v každé z těchto oblastí.

Obrázek 3. Schematické znázornění procesu tvorby liposomů.
(A) mikrofluidní samouspořádání liposomů
(B) standardní postup dávkového vstřikování ethanolu
Výhody mikrofluidiky pro zapouzdření nanočástic mRNA:
- Zkrácení dodacích lhůt
- Zvýšení účinnosti a kvality
- Snížení nákladů na vývoj /li>
- Vysoká propustnost
- Možnost automatizace a snadného škálování pro výrobu
Jak to funguje?
Mikrofluidní metody syntézy přímo mísí lipidovou organickou fázi s vodným roztokem mRNA v malém směšovacím čipu, kde dochází k rychlé a reprodukovatelné tvorbě lipidového nosiče a zapouzdření RNA. V poslední době byly vyvinuty automatizované mikrofluidní roztoky. Například Dolomite Automated Nanoparticle System (ANPS) zvyšuje produktivitu a zkracuje dobu vývoje automatickým generováním více vzorků za různých procesních podmínek. Po optimalizaci může systém běžet nepřetržitě a produkovat velké množství materiálu pro in vitro a in vivo zkoušky.
Úvod do mikrofluidního NanoF<.span class="h2-lowercase">abTx™
Ii>. soupravy pro optimalizaci lipidových nosičů
Soupravy zařízení a činidel pro nanoformulaci NanoFabTx™ jsou vhodné pro vývoj mRNA vakcín, protože řeší dva hlavní problémy při vývoji: (1) výběr a optimalizace lipového složení a (2) škálovatelné metody sestavování.
Soupravy NanoFabTx™ přístrojů a činidel nabízejí:
- zjednodušenou strategii pro screening a výběr požadovaných formulací bez nutnosti zdlouhavé optimalizace metodou pokus-omyl
- Výběr různých lipidových formulací, které byly studovány a vybrány pro podávání léčiv/RNA
- Sada mikrofluidního zařízení pro vytváření lipozomů zapouzdřených v mRNA s úzkou disperzitou velikosti a vysokou konzistencí jednotlivých dávek
- Komplexní protokoly, předem sestavené rozdělovače mikrofluidních čipů a potřebné příslušenství kompatibilní s mikrofluidním systémem Dolomite, stříkačkovými čerpadly nebo tradičními metodami nanoprecipitace
Výsledné lipidové nebo polymerní nosiče naložené léčivem nebo nukleovou kyselinou jsou biokompatibilní a biologicky odbouratelné a lze je dále upravit tak, aby byly zaměřeny na konkrétní tkáně nebo aby bylo zajištěno pomalé a trvalé uvolňování léčiva.
Kontrola velikosti a složení pomocí NanoFabTx.™ sada mikrofluidních nanozařízení
Sadu NanoFabTx™ zařízení lze použít k testování různých parametrů složení bez zdlouhavé optimalizace metodou pokus-omyl. Velikost liposomů lze jemně vyladit optimalizací parametrů, jako je poměr průtokové rychlosti (FRR) (obrázek 4A). Pomocí sady NanoFabTx™ mikrofluidního nanozařízení lze syntetizovat liposomy konzistentní velikosti bez ohledu na složení nebo koncentraci lipidů (obrázek 4B). Tento rychlý screening lipidů je nezbytný pro vývoj vakcín v rané fázi a často je nedosažitelný pomocí konvenčních metod hydratace/extruze lipidového filmu.

Obrázek 4. Optimalizace liposomů připravených pomocí mikrofluidické sady NanoFabTx™ - nanozařízení
.(A) PEGylované liposomy enkapsulující malou molekulu byly syntetizovány při různých poměrech průtoku (FRR, organický:vodný).
(B) Kationické liposomy enkapsulující siRNA byly syntetizovány při různých celkových koncentracích lipidů. Velikost liposomů byla měřena pomocí dynamického rozptylu světla (DLS).
Intracelulární dodávka liposomů naložených siRNA připravených pomocí NanoFabTx.™ soupravy činidel a zařízení
Doručování a vstřebávání liposomů naložených siRNA vyvinutých pomocí soupravy činidel a zařízení NanoFabTx™ bylo hodnoceno v mnoha aplikacích. Nejprve bylo prokázáno vychytávání kationických liposomů naložených fluorescenčně značenou FAMsiRNA v buňkách rakoviny plic A549 in vitro (obrázek 5). Nebylo pozorováno žádné vychytávání nahé FAMsiRNA. Oproti tomu více než 90 % buněk ošetřených liposomem nabitým FAMsiRNA (Lipo- FAMsiRNA) vykazuje silný fluorescenční signál, což svědčí o robustním vychytávání FAMsiRNA v komplexu s kationtovými liposomy.

Obrázek 5.Doručení nahé FAMSiRNA (horní panel) a FAMSiRNA komplexované s kationtovým liposomovým preparátem (dolní panel) v buněčné linii karcinomu plic A549. Všechny snímky byly pořízeny pomocí fluorescenčního mikroskopu.
Také bylo hodnoceno doručení siRNA a její schopnost umlčet buňky HeLa označené GFP in vitro. Liposomy s různým poměrem N/P (dusík (N) DOTAP/fosfát (P) siRNA) byly připraveny pomocí sady činidel a zařízení NanoFabTx™ a prověřeny z hlediska optimální účinnosti transfekce. Poměry N/P 7,5 a 5 vedly k podobné účinnosti transfekce a snížení exprese GFP přibližně o 40 % ve srovnání s neošetřenými kontrolními buňkami. Dále byly za účelem optimalizace účinnosti knock-down GFP-siRNA testovány tři různé sekvence siRNA. Dvě sekvence (siGFP-126 a siGFP-240) vedly k 40-50% umlčení (snížení exprese GFP) v buňkách GFP-HeLa (obrázek 6C&D). Tyto výsledky naznačují, že liposomy připravené pomocí platformy NanoFabTx™ nejenže dopravily siRNA do buněk GFP-HeLa, ale také účinně umlčely cílový gen. Kromě toho přímé srovnání metod přípravy lipozomů (mikrofluidika vs. extruze) prokázalo podobnou účinnost transfekce, ačkoli mikrofluidika se ukázala být jednodušší než pracná metoda extruze.

Obrázek 6.Lipozomy naložené siRNA připravené pomocí činidla NanoFabTx™ a soupravy zařízení umlčují expresi GFP v buňkách GFP-HeLa.
(A) Reprezentativní fluorescenční snímky a
(B) relativní exprese GFP/buňka (exprese GFP/buňka vzhledem k neošetřené kontrole) buněk GFP-HeLa ošetřených lipozomem-siRNA v různých poměrech N/P.
(C) Reprezentativní fluorescenční snímky a
(D) relativní exprese GFP/buňka buněk GFP-HeLa ošetřených lipozom-siRNA v komplexu s různými sekvencemi siRNA.
NanoF.abTx™ aplikace při vývoji vakcín
Tyto údaje demonstrují možnosti Sady NanoFabTX™ reagentů a zařízení při syntéze různých liposomů pro doručování RNA a dalších terapeutik. Flexibilita platformy NanoFabTX™ umožňuje optimalizaci pomocí screeningu parametrů, jako je složení a poměr průtokové rychlosti, dokud není dosaženo požadované velikosti lipozomu, zapouzdření léčiva a cíleného doručení. Společnosti MilliporeSigma a Dolomite spolupracují na vývoji mikrofluidních řešení pro syntézu lipozomů pomocí našich předem sestavených sestav NanoFabTX™zařízení a optimalizovaných protokolů. Tyto soupravy umožňují rychlou syntézu dobře definovaných částic, lze je přizpůsobit pro terapeutické léky, jako je mRNA a vývoj vakcín, a lze je zvětšit pomocí Automatizovaného systému nanočástic (ANPS) společnosti Dolomite pro předklinické hodnocení. Nový systém ANPS, kromě sestav NanoFabTX™, umožňuje uživatelům automatizovat experimenty pro výrobu malých vzorků lipozomů, lipidových nanočástic a dalších typů organických nanočástic, a řešit tak následující klíčové problémy ve vakcinologii:
- Řízená evoluce kmenů bakterií pro plazmidy
- Řízená evoluce optimálního kmene kvasinek/bakterií pro výrobu vakcíny
- Screening protilátek
- Vývoj a výroba adjuvantních formulací
- Vývoj a výroba částic pro doručení vakcíny
Sady reagencií NanoFabTx™
Odkazy
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?