Chitosan ve farmaceutických aplikacích
Raphael Riva, Christine Jerome
Center for Education and Research on Macromolecules University of Liege
Úvod
Vývoj nových zdravotnických prostředků a léčiv hraje ve zdravotnictví nedílnou roli. Přírodní i syntetické polymery mají výhody, které z nich činí cenné součásti v léčbě. Metody zapouzdření léčiv do polymerní matrice totiž prokázaly lepší terapeutickou účinnost a biologickou dostupnost a zároveň zabránily degradaci léčiva. V nanomedicíně byl vývoj nanonosičů na bázi polymerů poprvé zahájen v reakci na imunologické vedlejší reakce, s nimiž se setkáváme u nanonosičů na bázi virů.1,2 V této souvislosti se budeme zabývat nedávným nástupem metod, které využívají přírodní polymery a jejich deriváty jako nástroje k dosažení vysokého stupně biokompatibility s řízenou biodegradabilitou.3
Chitosan pro biomedicínské aplikace
Na trhu je k dispozici několik rodin přírodních polymerů. Chitosan je jedním z konkrétních příkladů polymeru, který byl v posledních několika desetiletích důkladně studován a ukázalo se, že je netoxický, semikrystalický,4 biologicky odbouratelný,5 a biokompatibilní6 polysacharid. Chitosan je náhodný kopolymer N-acetyl-glukosaminových a glukosaminových jednotek získaný deacetylací přírodního chitinu, obvykle za alkalických podmínek při relativně vysoké teplotě (obrázek 1).4 Přírodní chitin je obnovitelný zdroj, který lze získat z exoskeletu korýšů nebo hmyzu. Chitin lze také získat z neživočišných zdrojů, konkrétně z buněčných stěn hub.7,8 Obecně chitosan získaný z hub vykazuje užší distribuci molární hmotnosti a lepší sledovatelnost a reprodukovatelnost ve srovnání s chitosanem připraveným z živočišných zdrojů.

Obrázek 1. Chemická struktura chitosanu.
Prokázaná biokompatibilita a biologická odbouratelnost chitosanu rychle připravila půdu pro pokrok v řadě biomedicínských aplikací9 včetně scaffoldů pro tkáňové inženýrství.10 Například trojrozměrná porézní struktura chitosanu může být osázena citlivými bioaktivními látkami, včetně růstových faktorů.11 Kromě toho kombinované hemostatické12 a antimikrobiální13 vlastnosti chitosanu z něj činí vynikajícího kandidáta pro použití v obvazech na rány.14-15 Zejména tyto dvě vnitřní vlastnosti omezují riziko infekce, což následně zlepšuje regeneraci kůže. Hydrofilní povaha chitosanu z něj činí vhodný výchozí materiál pro použití v biodegradabilních a biokompatibilních hydrogelech. Mechanické vlastnosti hydrogelů citlivých na pH lze upravit kombinací chitosanu s jednoduchými přísadami, jako je hydroxyapatit, aby byly splněny specifické požadavky na použití.16
Chitosan pro farmaceutické aplikace
Ve farmaceutických aplikacích se chitosan.17 byl úspěšně použit při vývoji nosičů léčiv18-19 pro řízené podávání léčiv. Bylo prokázáno, že přítomnost kladných nábojů v chitosanu zvyšuje adhezi ke sliznici a v důsledku toho prodlužuje retenční čas.20 Kladně nabitá páteř chitosanu také umožňuje tvorbu stabilních elektrostatických komplexů s polyaniontovými makromolekulami, jako jsou polyfosfát21 nebo nukleové kyseliny.22 V důsledku toho je použití chitosanu pro enkapsulaci DNA nebo RNA v genové terapii oblastí významného výzkumu.23 Rozhodující význam má rozpustnost chitosanu, která závisí na pH. Chitosan je rozpustný ve vodě pod pH 6,5 v důsledku protonizace primární aminové skupiny. Pokud je požadována rozpustnost chitosanu při neutrálním pH, jsou k dispozici dvě možnosti: buď použití oligomerů chitosanu (523682), o nichž je známo, že jsou dobře rozpustné ve vodě v širokém rozmezí hodnot pH, nebo použití chemicky modifikovaného derivátu chitosanu. Zejména ethoxylace primárního alkoholu glukosaminových i acetyl-glukosaminových jednotek vede k O-glykol-chitosanu, plně ve vodě rozpustnému derivátu chitosanu.
Deriváty chitosanu pro doručování genů
Efektivní nevirové doručování nukleových kyselin se potýká s mnoha problémy, včetně degradace nukleázami a snížení účinnosti v důsledku záporných nábojů nahromaděných při přechodu přes buněčné membrány. Jedním z přístupů k řešení těchto problémů je tvorba polymerních komplexů, tzv. polyplexů, vytvořených prostřednictvím elektrostatických interakcí mezi polykationtem a záporně nabitou nukleovou kyselinou, jako je například známý syntetický nedegradabilní polyethylenimin. Při tvorbě polyplexu s chitosanem umožňuje přítomnost primární aminové skupiny na opakující se jednotce glukosaminu řídit hustotu náboje. Tato kontrola je závislá na stupni acetylace a na pH. Tyto vlastnosti vedly k úspěšnému použití chitosanu při nevirovém přenosu genů24 pro účely, jako je (1) umlčování genů (siRNA, shRNA), (2) kompenzace defektních genů a (3) výroba prospěšných proteinů nebo vakcín (DNA). Chitosan za mírně kyselých podmínek interaguje s nukleovými kyselinami, jako je DNA nebo siRNA, což vede ke kondenzaci nukleových kyselin do nanočástic. Tato technika byla úspěšně použita pro formulaci siRNA systému pro podávání léčiv podle procesu iontové gelace.25 Navíc biokompatibilita a nízká toxicita chitosanu umožňují jeho použití in vivo.26 Aby se dosáhlo stálosti náboje a rozpustnosti27 v širším rozsahu pH podobně jako u jiných kationtových syntetických polymerů, jako je poly-l-lysin, byla zkoumána kvaternizace primárního aminu chitosanu.28 Kvartérní amin byl obvykle generován reakcí s methyljodidem s následnou substitucí jodidového protiiontu chloridovým iontem ionexovým procesem. Výsledný N,N,N-trimethylchitosanchlorid (TMC) je v literatuře nejčastěji uváděným kvaternizovaným chitosanem používaným pro transfekci v aplikacích genové terapie.29 Kvaternizace chitosanu zlepšila stabilitu iontových komplexů oproti komplexům na bázi čistého chitosanu. Další derivatizace chitosanu umožnila zlepšit vlastnosti TMC. Například kombinací kvaternizace a roubování thiolu na TMC se získávají mukoadhezivní vlastnosti TMC tvorbou disulfidů s mucinovými proteiny buněčné membrány.30 Dalším příkladem je přeměna některých primárních aminů v chitosanu na karboxylové kyseliny reakcí s anhydridem jantarovým, což vede ke zlepšení rozpustnosti v neutrálním vodném prostředí.31 Shromážděný kyselinotvorný chitosan vykazuje vyšší rozpustnost ve vodě, pokud je alespoň 20 mol % primárních aminů převedeno na karboxylové kyseliny. Přestože se ukázalo, že stabilita komplexu karboxylovaného chitosanu s DNA je slabší než u čistého chitosanu, byla pozorována lepší účinnost transfekce.
Další možností, jak zlepšit doručení genu, je roubování polymerů nebo funkčních skupin na chitosan. Štěpování dalších polymerů nebo funkčních skupin může vést k lepší rozpustnosti a lepší pufrovací kapacitě ve srovnání s nemodifikovaným chitosanem. Bylo například prokázáno, že zavedení sekundárních a terciárních aminoskupin zlepšuje účinnost transfekce chitosanu.34 Tato jednokroková syntéza byla založena na roubování imidazolu nesoucího karboxylovou kyselinu na chitosan za vzniku amidu, zprostředkovaného 1-ethyl-3-(3-dimethylaminopropyl) karbodiimidem (EDC). Tento jednoduchý a reprodukovatelný postup zlepšil rozpustnost i pufrovací kapacitu syntetizovaných derivátů chitosanu.
Deriváty chitosanu pro podávání léčiv
Nedávné vývojové snahy v rámci farmaceutického průmyslu vyústily v řadu vysoce hydrofobních, a tudíž ve vodě špatně rozpustných kandidátů na aktivní farmaceutické látky (tj. kandidátů na léčiva třídy BCS II a IV). Tato nedostatečná rozpustnost značně snižuje biologickou dostupnost kandidáta na léčivo a komplikuje jeho vývoj, což brání jeho komercializaci. K enkapsulaci hydrofobních kandidátů na léčiva lze použít cílené nanonosiče, které umožňují intravenózní podání.35 Ukázalo se, že atraktivním kandidátem na enkapsulaci hydrofobních léčiv je derivatizovaný chitosan. Štěpováním hydrofobních částí na páteř chitosanu získal syntetizovaný polymer amfifilní vlastnosti. Bylo prokázáno, že tento amfifilní kopolymer se sám organizuje do micel, přičemž léčivo je solubilizováno v hydrofobním jádru. Alkylové řetězce byly původně naroubovány na chitosan reakcí alifatických aldehydů s primárním aminem v páteři chitosanu za vzniku odpovídající Schiffovy báze. Následovala redukce pomocí NaBH4.36-37 Tato strategie úspěšně umožnila roubování alkylových řetězců C3, C5, C6, C8 a C12 na chitosan.38-40 Amfifilní vlastnosti lze přesněji vyladit roubováním hydrofobních i hydrofilních složek na jedinou páteř chitosanu. Úspěšně bylo také dosaženo postupného roubování oktylových řetězců redukční aminací s následným roubováním sulfátu.41 Zkoumáno bylo také roubování aromatických kruhů, konkrétně 2-karboxybenzoylových skupin nebo ftalimidových skupin.42-43
Bylo také prokázáno použití obnovitelných materiálů pro modifikaci chitosanu. Zde byly mastné kyseliny roubovány na chitosan pomocí spojovací reakce mezi primárním aminem chitosanu a karboxylovou kyselinou mastné kyseliny zprostředkované EDC v roztoku methanolu a vody.44-45 Pomocí této techniky byla na oligochitosan úspěšně roubována nasycená kyselina stearová a nenasycená kyselina lineoová. Tyto deriváty pak byly modifikovány kyselinou cholanovou a cholesterolem. Modifikovaný glykol-chitosan s kyselinou 5-β-cholanovou byl intenzivně studován jak in vivo , tak in vitro jako nosič docetaxelu a paklitaxelu.46,47 Podobně byla na chitosan úspěšně naroubována kyselina tokoferol-PEG-karboxylová.48
Chitosan lze také modifikovat syntetickými postranními řetězci, zejména biokompatibilními a hydrofobními alifatickými polyestery. Štěpení poly(ε-kaprolaktonu) (PCL) bylo ve velké míře zkoumáno pro syntézu amfifilních biokompatibilních kopolymerů na bázi chitosanu, a to jak technikou "štěpení z", tak technikou "štěpení do" (obrázek 2).49-50 Při technice "grafting from" byla polymerace ε-kaprolaktonu iniciována přímo primárním aminem nebo hydroxylovými skupinami přítomnými na řetězci chitosanu. V případě techniky "roubování na" byly polymerní řetězce nesoucí příslušnou funkční skupinu na jednom konci řetězce naroubovány na primární amin nebo hydroxylové skupiny chitosanu.51

Obrázek 2.Ilustrace technik "roubování z" a "roubování do".
Selektivní iniciace polymerace nebo roubování předem připraveného polymerního řetězce výhradně hydroxylovými skupinami lze dosáhnout, pokud jsou primární aminy před reakcí chráněny a po ní deprotovány.50,52-53 Pozoruhodné je, že primární aminy chitosanu lze chránit vytvořením stabilního elektrostatického komplexu s kyselinou methylsulfonovou, který se po polymeraci snadno odstraní vysrážením ve fosfátovém pufru. Reakce chitosanu s ftalanhydridem je dalším způsobem účinné ochrany primárních aminových skupin. Taková ochrana také zlepšuje rozpustnost chitosanu v organických rozpouštědlech, konkrétně v dimethylformamidu.54 Esterové nebo uretanové vazby jsou dva příklady organických funkcí používaných pro roubování PCL zakončené karboxylovou kyselinou.55 nebo isokyanátovou skupinou,54 resp. na hydroxylové skupiny ftalimid-chitosanu (obrázek 3).
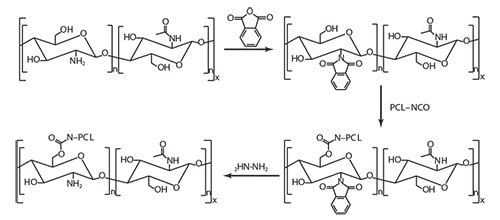
Obrázek 3. Štěpování PCL na chitosan chráněný phtalimidem.
V porovnání s technikou "roubování z" se ukázalo, že technika "roubování do" umožňuje lepší kontrolu počtu a molekulární hmotnosti PCL štěpů na chitosanu. Štěpování polymerních řetězců na chitosan není omezeno pouze na PCL. Štěpování řetězců PEG na chitosan je v literatuře široce popsáno.51,56 Nedávno byly na primární aminy chitosanu naroubovány řetězce PEG zakončené karboxylovou kyselinou. Výsledný roubovaný kopolymer vykazoval sníženou cytotoxicitu ve srovnání s neupraveným chitosanem.51 Heterograftovaný chitosan obsahující jak PCL, tak PEG přívěsné řetězce syntetizovali Liu, a další. současným roubováním PEG a PCL zakončených karboxylovou kyselinou na hydroxylovou skupinu ftalimid-chitosanu, což vedlo k jemně vyladěným amfifilním vlastnostem.57
Nakonec glukosamin58 (GlcNH2), deacetylovaná monomerní jednotka chitosanu, může být s výhodou použit k dekoraci nanočástic pro podávání antibakteriálních a protinádorových léčiv.59-60 Je totiž známo, že GlcNH2 je toxický pro několik maligních buněčných linií, jako jsou buňky lidského hepatomu, prostaty, leukémie a rakoviny prsu.61-64 GlcNH2 by tedy mohl být slibným cílem pro léčbu zhoubných nádorů díky svému inhibičnímu účinku na transglutaminasu 2 (TGase2), která přispívá k rezistenci vůči lékům.62 GlcNH2 byl také použit jako ligand v systému pro podávání léčiv zaměřeném na ledviny pro podávání prednisolonu, což vedlo ke zvýšení koncentrace prednisolonu in vivo.65
Závěry
Chitosanu byla věnována značná pozornost jako funkčnímu biopolymeru pro různé farmaceutické a biomedicínské aplikace. Chitosan je netoxický, biokompatibilní a biologicky odbouratelný polymer. Lze jej formulovat jako nanonosič s využitím iontových interakcí, což vede k vytvoření koloidních systémů s léčivem, které mají mukoadhezivní a pozoruhodné vlastnosti zvyšující permeaci. Kromě toho lze tento polysacharid citlivý na pH formulovat také jako hydrogel.
Kationtové vlastnosti chitosanu umožnily jeho rozsáhlé využití pro doručování genů. Zatímco chitosanové nanočástice s nukleovou kyselinou vyrobené z nativního chitosanu vykazují nízkou pufrovací kapacitu a omezenou stabilitu, chemicky modifikovaný chitosan může pomoci zlepšit in vivo účinnost transfekce prostřednictvím: (1) kvaternizace pro zlepšení rozpustnosti a stability nanočástic, (2) roubování polymerních řetězců pro zlepšení endosomálního úniku nebo (3) roubování ligandů pro specifické cílení na buňky. Pokud je k chitosanu konjugována hydrofobní část, může se výsledný polymer sám sestavit a zapouzdřit špatně rozpustné léčivo. Štěpení steroidu, mastné kyseliny nebo PCL na chitosan nebo glykolchitosan může také vést k nanonosičům, které jsou užitečné pro doručování léčiv, zejména pasivní nebo aktivní cílení protinádorových léčiv na nádory.
Odkazy
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?