CC050
Human Collagen Type I
from human placenta, liquid, 1 mg/mL, suitable for cell culture, used for gel formation
Sinonimo/i:
Human Collagen
About This Item
Prodotti consigliati
product name
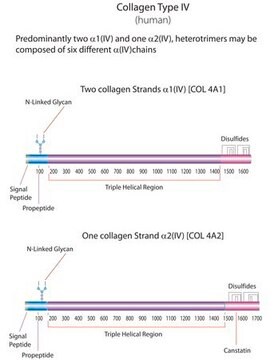
Collagene di tipo IV umano,
Origine biologica
human
Livello qualitativo
Saggio
>90% (collagen type I, SDS-PAGE)
Forma fisica
liquid
Produttore/marchio commerciale
Chemicon®
Concentrazione
1 mg/mL
tecniche
cell culture | mammalian: suitable
Impurezze
<1% collagen type II,IV-VI & non-collagen proteins.
<10% collagen type III
input
sample type pancreatic stem cell(s)
sample type mesenchymal stem cell(s)
sample type epithelial cells
sample type induced pluripotent stem cell(s)
sample type neural stem cell(s)
sample type: human embryonic stem cell(s)
sample type hematopoietic stem cell(s)
Solubilità
water: soluble at 20 °C
N° accesso NCBI
N° accesso UniProt
Specificità del legame
Peptide Source: Elastin
Peptide Source: Fibronectin
Condizioni di spedizione
dry ice
Temperatura di conservazione
−20°C
Informazioni sul gene
human ... COL1A1(1277)
Descrizione generale
Applicazioni
- come controllo nel saggio con cellule reporter del fattore nucleare 2B4 delle cellule T attivate (NFAT)–GFP, dove la sua interazione con le cellule reporter può essere valutata per l'espressione di GFP guidata dal promotore del fattore nucleare delle cellule T attivate (NFAT)
- per il rivestimento di vetrini in saggi di legame dinamico per creare un substrato per il legame specifico e lo studio di piastrine e coniugati nei canali di flusso
- come standard proteico nell'analisi istologica di campioni di tessuto polmonare, fornendo un riferimento per la composizione e la caratterizzazione dei componenti della matrice extracellulare (ECM)
Azioni biochim/fisiol
Stato fisico
Risultati analitici
Note legali
Esclusione di responsabilità
Codice della classe di stoccaggio
12 - Non Combustible Liquids
Classe di pericolosità dell'acqua (WGK)
WGK 1
Punto d’infiammabilità (°F)
Not applicable
Punto d’infiammabilità (°C)
Not applicable
Certificati d'analisi (COA)
Cerca il Certificati d'analisi (COA) digitando il numero di lotto/batch corrispondente. I numeri di lotto o di batch sono stampati sull'etichetta dei prodotti dopo la parola ‘Lotto’ o ‘Batch’.
Possiedi già questo prodotto?
I documenti relativi ai prodotti acquistati recentemente sono disponibili nell’Archivio dei documenti.
I clienti hanno visto anche
Articoli
Extracellular matrix proteins such as laminin, collagen, and fibronectin can be used as cell attachment substrates in cell culture.
Protocolli
This page covers the ECM coating protocols developed for four types of ECMs on Millicell®-CM inserts, Collagen Type 1, Fibronectin, Laminin, and Matrigel.
Il team dei nostri ricercatori vanta grande esperienza in tutte le aree della ricerca quali Life Science, scienza dei materiali, sintesi chimica, cromatografia, discipline analitiche, ecc..
Contatta l'Assistenza Tecnica.