Fase preclinica

Le prove precliniche servono a stabilire se il composto candidato farmaco dimostra le caratteristiche di sicurezza ed efficacia necessarie per passare alle prove sull’uomo. In questa fase, possono essere necessari diversi anni per completare i test richiesti in vitro e in vivo; in caso di esito positivo, si può passare alla preparazione e quindi alla presentazione della domanda di autorizzazione della sperimentazione clinica (IND).
Risorse per le imprese biotecnologiche
- FDA Investigational New Drug (IND) Application
Explore FDA’s guidance on IND applications, a crucial step in drug development for biotech startups. Navigate regulatory intricacies efficiently.
- Emerging BioTalk Blog
Your gateway to the latest news in biotech. Dive into discussions on market trends, bioprocessing, and technologies for novel modalities. Join the discussion today.
- Brochure: Integrated Bioprocess Solutions
Navigate the path to commercialization with our comprehensive guide for Biopharmaceutical Startups. Accelerate your journey with our range of tools and services.
- Biopharmaceutical Application Guide
Navigate the biopharmaceutical landscape with our application guide, providing resources and solutions for mAb, ADC, and mRNA processes.
I servizi di studi tossicologici rivestono un’importanza cruciale. Occorre infatti far ricorso a un ampio spettro di test tossicologici in vitro ed in vivo, da inquadrare in un disegno sperimentale che rispetti le linee guida internazionali e sia poi condotto in piena conformità con la regolamentazione delle buone pratiche di laboratorio (GLP)
Criticità nello sviluppo del processo
- Sviluppo di linee cellulari
- Selezione del clone
- Screening dei terreni e dei nutrienti
- Sviluppo delle fasi upstream del processo
- Realizzazione di banche cellulari primarie
- Sviluppo delle fasi downstream del processo
- Sviluppo della formulazione
- Sviluppo e ottimizzazione dei metodi analitici
- Assistenza allo sviluppo delle procedure analitiche
- Programmi analitici di confronto tra biosimilari
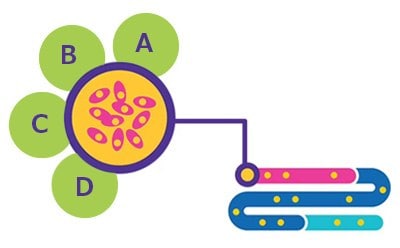
Figura 1.Sviluppo della linea cellulare. A. Servizi BioReliance® di caratterizzazione del prodotto. B. Servizi BioReliance® di creazione e stoccaggio di banche cellulari. C. Servizi BioReliance® di sviluppo di linee cellulari. D. Servizi BioReliance® di caratterizzazione di linee cellulari.
Criticità nello sviluppo di linee cellulari
- Scelta del clone – è essenziale disporre di linee cellulari che possano produrre il principio biologico a livelli di concentrazione e di qualità sufficientemente elevati
- Studi di robustezza – studi che riproducono le condizioni di scale-up del processo
- Stabilità genetica – la produzione e la qualità della proteina devono rimanere stabili anche dopo un numero di generazioni cellulari >60
Criticità nello sviluppo del processo
- Efficienza del processo – occorre eliminare i passaggi superflui e ottimizzare l’utilizzo della capacità produttiva
- Fattibilità del processo – riproducibilità a livello di scale-up e di trasferimento tecnologico
- Fattibilità finanziaria – occorre bilanciare la produttività con i o costi

Criticità tecnologiche
- Flessibilità – l’impiego di attrezzature monouso incrementa la flessibilità, la possibilità di ricorrere a modelli predefiniti, la rapida configurazione delle linee e riduce i costi di lavaggio
- Scalabilità – al momento della scelta delle tecnologie nelle fasi iniziali dello sviluppo, come nel caso dello scale-up di un bioreattore per colture di cellule di mammifero da 3 L a 200 L e poi a 2.000 L
- Facilità d’uso – ricorrendo a soluzioni come linee di flusso preassemblate per processi sterili e interfacce che consentano connessioni, disconnessioni e riconnessioni sterili
Criticità normative
- Sicurezza del paziente – è prioritario che ad ogni passo in avanti dello sviluppo clinico siano verificate la sicurezza e l’efficacia del prodotto
- Qualità del prodotto e robustezza del processo – sono indispensabili la raccolta e l’analisi dei dati che ne diano conferma
- Strategia di registrazione – la conoscenza dei paesi in cui si intende registrare il farmaco è un riferimento essenziale per chi ispeziona gli impianti produttivi
Criticità in fase di commercializzazione
- Velocità di ingresso sul mercato – in ricerca e sviluppo gli investimenti senza ritorno sono di entità riguardevole
- Efficienza del processo – è necessario tenere in debito conto per tempo non solo la velocità del processo nelle prime fasi di sviluppo, ma anche i passaggi di scala che seguiranno
- Strategia di registrazione – è essenziale stabilire in quale paese presentare richiesta per primo per guadagnare in fretta l’accesso al mercato
Poter accedere alle giuste risorse permette di concentrare gli sforzi nella scoperta di nuove soluzioni con il massimo potenziale di successo a vantaggio di pazienti bisognosi. Selezionate una qualsiasi delle tappe del processo di sviluppo per esplorare le risorse a vostra disposizione, oppure seguite i link ai prodotti e ai servizi.
Hub delle risorse biotech: il percorso a tappe


Drug discovery
Identificazione degli studi, delle risorse e del sostegno che occorrono per sviluppare un nuovo candidato farmaco biologico

Fasi I e II
Possiamo accelerare lo sviluppo del processo con suggerimenti, modelli e guide applicative

Fase III e produzione
Passaggio dallo scale-up e dal trasferimento di tecnologie a una produzione di qualità per i trial clinici e la commercializzazione

Programmi per startup
Possiamo aiutarvi a trovare risorse e programmi di sostegno in grado di valorizzare il potenziale della vostra molecola

Contesto normativo
Destreggiatevi in un settore industriale tra i più regolamentati al mondo con una guida di fiducia al vostro fianco
Per continuare a leggere, autenticati o crea un account.
Non hai un Account?



