96 孔系統中的藥物轉運分析:重現性及與人體吸收的相關性
Andrew Arena, Jeanne Phillips, Mark Blanchard
EMD Millipore Corporation, Life Science Division, Danvers, MA
背景
新藥的成功開發必須包括吸收、分佈、代謝、排泄和毒性 (ADMET) 特性的測試,以確保它們適合口服給藥。吸收的定義是藥物從給藥部位到作用部位之間穿透上皮和內皮細胞屏障的能力。吸收可透過被動的細胞外或細胞內擴散、主動的載體轉運或主動的外流機制來進行。目前已開發出數種方法來協助了解化學化合物的吸收。最常見的是使用永生化細胞系(如 Caco-2、MDCK 等)來模擬腸道上皮。1,2
Caco-2細胞株是異質的,來自人類結腸直腸腺癌。Caco-2細胞被用作預測人類腸道吸收的體外滲透性模型,因為它們表現出吸收性腸細胞的許多特徵。3 Caco-2 細胞被用作預測人體腸道吸收的體外滲透性模型,因為它們表現出吸收性腸細胞的許多特徵4-6 。這包括它們能自發分化成極化的腸細胞,表達高水平的刷狀邊界水解酶,並形成發達的結合複合物(見圖 1,分化的 Caco-2 細胞的橫切面電子顯微圖 (EM))7。Caco-2 細胞也表達多種轉運系統,包括二肽轉運體和 Plycoproteins (Pgp)。由於這些特性,藥物在 Caco-2 細胞中的滲透性與人體口服吸收有很好的關聯性,使得 Caco-2 成為理想的體外滲透性模型。8, 9 當藥物經過 Caco-2 輸送模型的跨細胞擴散時,可以獲得新陳代謝和潛在的藥物交互作用的額外資訊。10
雖然 Caco-2 細胞模型精確且研究深入,但需要投入大量的時間和資源。根據初始播種密度、培養條件和通過數等多種因素,Caco-2 細胞可能需要長達 20 天的時間才能達到融合並實現完全分化。在這 20 天內,細胞需要每隔一天以手動或自動方式更換一次培養基。轉運實驗會消耗寶貴的藥物化合物,通常需要昂貴的轉運後樣品分析(例如 LC/MS)。因此,要在高通量實驗室環境中使用 Caco-2 輸送模型,平台必須堅固耐用、與自動化相容、重複性高,並能提供與既有方法相關的高品質資料。
簡介
Millipore Millicell-96 系統是可靠的 96 孔平台,可用於預測人體對藥物化合物的口服吸收(使用 Caco-2 細胞或其他藥物轉運特性已被充分表徵的細胞系)。系統格式與自動化相容,與 24 孔系統相比,可提供更具成本效益、更高通量的藥物篩選。Millicell-96 系統在所有 96 孔中的細胞生長和藥物滲透性均具有良好的均勻性,且不同生產批次之間的差異性較低。該板的設計支援使用較少量的昂貴培養基和較少量的測試化合物。使用 Millicell-96 系統,可成功地將標準藥物化合物分類為高滲透性或低滲透性,符合
食品藥物管理局的定義,且滲透性數據與已建立的人體吸收值關係良好。11
本應用註釋中提供的數據表明,使用 Millicell-96 系統獲得的藥物滲透率與已公佈的人體腸道吸收值關係良好。此外,在將一個板與另一個板進行比較以及測試多個批次的板時,板內的性能是一致的。ArQule, Inc.12
這些結果涵蓋了大量化合物的測試,最初在加拿大多倫多舉行的 2002 AAPS 年會暨博覽會的海報上發表。此外,還進行了實驗,比較使用 Millicell-96 系統與使用 24 孔系統測量的藥物滲透率。這項研究的目的在於確定使用 Millicell-96(即 96 孔平台)所獲得的資料是否與使用既有系統所獲得的滲透性結果具有可比性,進而間接提供與人體吸收百分比的額外相關性。最後,透過測試普萘洛爾在從不同生產批次中選出並在不同日期接種細胞的多個 Millicell-96 上所有 96 孔中的傳輸情況,探索了產品的可變性。
圖 1 (左):截面 EM 圖 2 (右):Millicell-96 分化的 Caco-2 細胞
成分:

Millicell-96 分析系統組件(cat. PSHT004R5,含單孔
飼料板)和 96 孔傳輸分析板(cat.MACA C0R S5)。未顯示,
分析系統組件,含96孔輸送分析板(cat. PSHT004S5)。
材料和設備
組織培養
非必需氨基酸(cat. M7145),HEPES(cat. H0887),青黴素,鏈黴素和L-谷氨酰胺(cat.G1146)、EDTA(cat.E8008)、胰蛋白酶/EDTA(cat.T3924)和多壁洗板機、8 通道分流板(cat.M2656)均購自 Sigma Chemical Co. (St. Louis, MO)。Fetal bovine serum (cat. 16000044) 和 Hank's balanced salt solution (HBSS) (cat. 14025) 均購自 Invitrogen (Carlsbad, CA)。Millicell-96 系統 (cat. PSHT004S5 或 PSHT004R5) 購自 Millipore Corporation (Bedford, MA)。Corning HTS Transwell®'-24平板和贮槽(cat. 07200687 和 08774162)以及组织培养瓶(cat. 1368065)购自 Fisher Scientific。
電阻測量 用於 24 孔板的 Millicell®-ERS-2 探針 (cat. MERSSTX01) 和 Millicell-ERS ohm meter (cat. MERS00002) 均購自 Millipore Corporation。Millipore 板中測量電阻的電極(cat. STX 100M)購自 World Precision Instruments (Sarasota, FL)。
藥物運輸實驗
普萘洛爾(cat. P0884)、睪酮(cat.T1500), digoxin (cat. D6003), mannitol (cat. M9546), paclitaxel (Taxol®) (cat. T1912), prednisone (cat. P6254), ibuprofen (cat. I1892), verapamam.I1892), verapamil (cat. V4629), warfarin (cat. A2250) and methotrexate (cat. M8407) were purchased from Sigma Chemical Co. (St. Louis, MO).放射性標記甘露醇 (NET101)、地高辛 (NET222)、普萘洛爾 (NET515)、睾酮 (NET553) 和維拉帕米 (NET810) 購自 PerkinElmer (Boston, MA)。放射性標示的紫杉醇 (MT-552)、甲氨喋呤 (MT-701) 和華法林 (MT-1620) 購自 Moravek (Brea, CA)。放射性標示的布洛芬 (ART-392) 和潑尼松 (ART-836) 購自 ARC (St. Louis, MO)。Wallac 1450 Microbeta® Plus Scintillation Counter、Microbeta Trilux Multiwell Plate Scintillation Counter 和 Microbeta 96 孔彈性板 (1450-401) 購自 Wallac/PerkinElmer (Boston, MA)。
Methods
Performing Drug Transport Assays
有關 Caco-2 Cells 的培養和飼養、Millicell-96 系統的細胞接種密度最佳化,以及使用 Millicell-96 系統進行藥物轉運分析的具體方法,請參閱 Millipore Protocol Note PC1060EN00:使用 96 孔分析系統進行藥物轉運分析研究的 Caco-2 細胞生長和分化的最佳化。13
在這些實驗中,Caco-2 細胞在組織培養瓶中培養至 80-90% 匯合。在四次獨立實驗(每次實驗都在不同的一天進行)中,以 33-35 齡的細胞作為一個 MultiScreen Caco-2 板(96 孔過濾板,cat. PSHT004S5 或 PSHT004R1)和四個 24 孔板的種子,進行 21 天的細胞生長。Millicell-96 的最佳播種密度為每 cm 82,000 cells2 ,24 孔板的最佳播種密度為每 cm 67,000 cells2 。
21天後,測量每孔的經上皮層電阻(TEER)。(TEER值低於100 ohms x cm2 的孔不符合先前建立的細胞單層形成接受標準,這些孔的數據不納入圖表中)。接著用 pH 7.4 的無菌 HBSS 洗板三次。將 10 種氚標示化合物稀釋 100 倍至含有各自未標示化合物的溶液中。在 pH 7.4 的 HBSS 中將此混合物調至 10 µM 的最終濃度,然後在每個平板的所有 96 個孔的頂部加入。使用 Trilux 多孔板閃爍計數器測量每分鐘放射性標示藥物的計數,兩小時後(37 °C、5% CO2、95% 相對濕度下振動)測定藥物的轉移。藥物滲透能力值則使用下一節所述的公式計算。Millicell-96 試劑板以每平方厘米 65,000 個細胞的密度播種,細胞生長 21-28 天。非放射性標示化合物 (20 µM) 的滲透性在兩小時後測量,並在 37 °C 下震盪。使用液相色譜/質譜法分析樣品。在 80 分鐘內的不同時間點,測量放射性標示化合物 (微量與 1 µM 的各自未標示對應物混合) 的滲透性。
評估藥物傳輸實驗的重複性
在這些實驗中,在三個獨立實驗(每個實驗在不同的一天進行)中,使用 33 和 34 胞期的細胞播種來自三個不同批次的 PSHT004S5 和一個批次的 PSHT004R5 的平板進行 21 天的細胞生長。播種密度和 TEER 評估及藥物轉運實驗的表現如上所述。

結果
單層完整性的評估
在所有藥物傳輸實驗開始之前,在每個孔中測量 TEER,以確認單層完整性。本節討論的所有實驗的 TEER 測量通常在 200 到 350 ohms x cm2 (資料未顯示)。此範圍顯示在培養 21 天後成功形成完整的單層。
藥物傳輸率與人體吸收率的相關性
從歷史上看,用體外 Caco-2 模型測量的藥物吸收率與人體吸收率之間存在一對鋸齒關係。8 在 ArQule, Inc. 使用 Millicell-96 系統測試了代表主動、被動和 外流轉運體的藥物化合物。12 每種化合物的滲透率都與它們的人體吸收百分比值作了對比(圖 3)。本評估包括的被動擴散化合物有卡馬西平、甘露醇、青霉素、咖啡因、丁螺环酮、甲氧氯普胺、氟哌啶醇、丙咪嗪和丙咪嗪。活性流入化合物包括甲氨蝶呤、吡羅昔康、水楊酸和 Gly-Sar。外流化合物包括洛哌丁胺、氯米帕明、美托拉宗、阿普仑洛尔、噻吗洛尔、美托洛尔、地高辛、氯丙嗪、奎宁、紫杉醇、噻嗪酮、醋丁洛尔、磺胺沙拉嗪、多柔比星和硫利达嗪。使用 Statistica™ (Stat Soft Corporation, Tulsa, OK) 產生一條非線性回歸曲線, 公式 2,並提供所有資料點的良好擬合。該曲線的統計分析顯示,根據藥物是否被主動吸收、被動吸收或外流,其擬合度並無顯著差異 (ANOVA F-test on single curve ranked residuals; p=0.33)。 根據曲線擬合,高和低滲透性化合物的轉運速率通常分別為 > 1.0 x 10-5 cm/s 和 < 1.0 x 10-6 。據估計,中間化合物的滲透上限為 ~7.0 x 10-6。這項研究證明 Millicell-96 系統能夠正確辨識所有 25 種受測化學化合物的滲透特性並加以分類。

圖 3: 藥物傳輸速率與人體吸收的相關性*

* 一個異常值特非那定 (terfenadine) 的 Papp 值為 1x10-7 cm/s,且人體缺氧百分比 = 100%,因此未包括在內。
藥物傳輸的相關性
與 24 孔板結果的相關性
大量文獻支持使用 24 孔系統進行體外藥物滲透性模型。在開發或驗證 96 孔平台時,將資料與使用先前建立的方法所獲得的結果相互關聯是很重要的。使用相同的細胞和方法進行實驗,比較 Millicell-96 和既有的 24 孔系統所獲得的藥物轉移率。使用 Millicell-96 或 24 孔分析系統測量 10 種氚標示藥物 (甘露醇、地高辛、普萘洛爾、睪酮、紫杉醇、潑尼松、維拉帕米、華法林、布洛芬和甲氨蝶呤) 的 Caco-2 滲透率。圖 4 比較了來自四個獨立實驗的資料。R2 值為 0.99,表明兩種不同格式(即 24 孔和 96 孔)之間的數據關聯性良好。 將轉運率(不包括地高辛和 Taxol)與人體吸收值(圖 5)對比作圖時,進一步證明了良好的關聯性。圖 3 中產生的相同曲線完全符合兩組資料。因此,當採用 Millicell-96 系統進行體外滲透性研究時,預計數據將與 24 孔系統相關。
圖 4.滲透率的比較:Millicell-96 和 24 孔分析系統
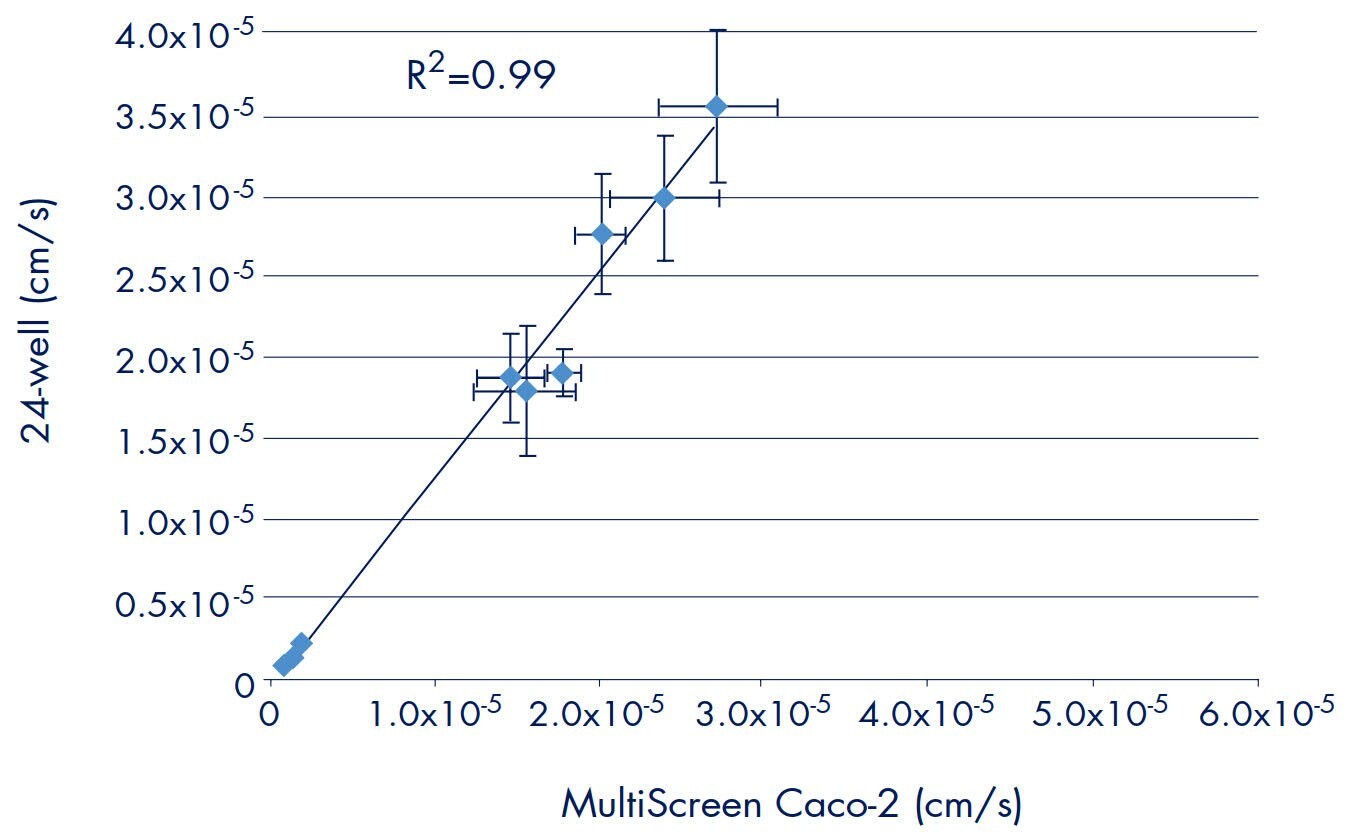
註: 用於創建圖 4 和圖 5 的平均傳輸率不包括任何明顯離群的複製品。
圖5,Papp vs. 人體吸收-Millicell-96和24孔分析系統的比較
注意: 製作圖4和圖5所用的平均傳輸率不包括任何明顯離群的複製品。

藥物轉運速率的可重複性
以細胞為基礎的體外方法的可靠性取決於細胞生長平台所造成的變異性最小化。從環境和工業的角度來看,使用多孔板長期培養細胞可能是一項挑戰。在培養過程中,即使是在濕度可控的培養箱中,溫度升高也會使板外孔的蒸發比板內孔更快。每天平板播種的微小差異也可能造成變異。基於這些因素,我們在 Millicell-96 系統中使用培養 21 天的 Caco-2 細胞和單一藥物(普萘洛爾),在每個測試板的所有 96 孔中檢測藥物傳輸速率的重現性。轉運速率是從頂部到基側方向測定的。變異分量是由在不同日期進行的三次實驗所組成的資料集計算出來的。每個實驗包括四個不同生產批次的 Millicell-96 板、三個帶有 96 孔進液盤的批次(進液盤來自 MACA CO2 S5)和一個帶有單孔進液盤的批次(進液盤來自 MACA CO2 B5)。本研究中所有 12 個板的普萘洛爾在外 36 孔與內 60 孔的板內傳輸比較圖已繪製完成 (圖未顯示)。結果 R2=0.9 確認外側孔 (n=36) 的平均值和變異性與內側孔 (n=60) 的平均值和變異性在統計學上相似。
對所有 12 個平板的平板平均值、平板間和平板內標準差 (SD) 進行了方差分析。這些實驗的整體板平均滲透率為 1.5 x 10-5 cm/sec。板內和板間的標準偏差估計為 0.2 x10-5 cm/sec,且在不同生產批次或測試天數之間沒有顯著差異(分別為 p>0.07 和 p>0.17)。利用這些值,使用等式 3 計算出單次測量的總標準差 (total SD) 為 0.3 x10-5 cm/sec
因此,使用 Millicell-96 系統進行的普萘洛爾輸送實驗的所有結果中,有 95% 預測會落在使用等式 4 確定的範圍內。由此預測,本研究中所有普萘洛爾轉運速率(從頂端到基底層)的 95% 應落在 0.9 到 2.1 x 10-5 cm/sec 的範圍內。這些實驗也證明,置信範圍應可達到,不受孔位、平板生產批次、使用的供料盤類型或實驗日的影響(圖 6)。畫出一條代表低滲透性化合物上限的線(由圖 3 推斷),證明 95% 的置信範圍可清楚區分普萘洛爾為高滲透性化合物或低滲透性化合物。


圖 6.普萘洛爾轉運的板間差異*
圖 6.普萘洛爾轉運的板間差異*
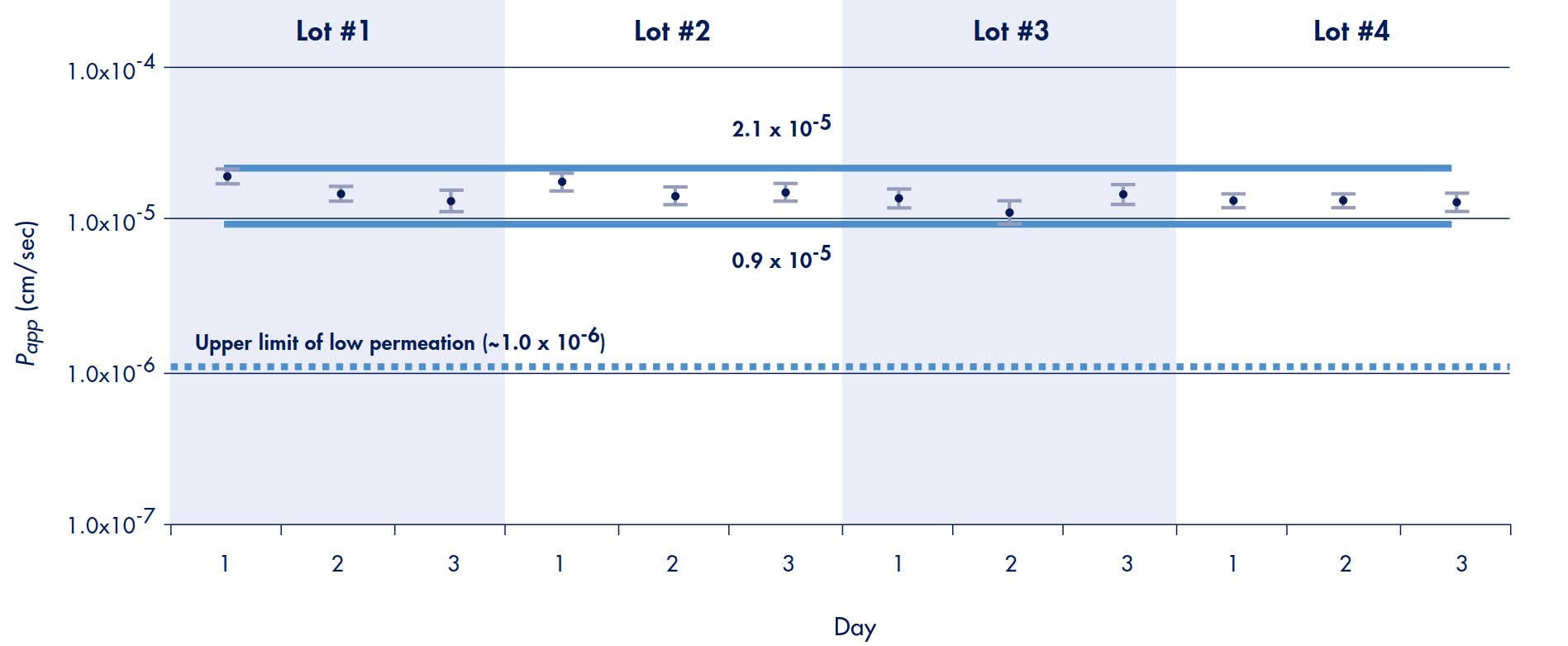
*註:每個數據點代表一個單板,以及 96 孔的平均值和標準差
。討論
Caco-2細胞是異質的,其最終培養的特性可能會因為特定實驗室的選擇壓力而有所不同。除非使用相同的 Caco-2 細胞和條件,否則無法直接比較實驗室之間的化合物滲透率。14 因此,特定藥物的轉運率和滲透性分類範圍預計會與本應用註釋中提供的數據有所不同。最重要的是能夠成功地將化合物分類為低滲透、中滲透或高滲透藥物,並產生與既定人體吸收值相關的轉運結果。如圖 3 所示,Multi-Screen Caco-2 分析系統滿足了這些要求。從該曲線推斷得出的範圍可根據滲透性正確分類所有化合物。與 24 孔系統的比較研究得出高度的相關性。這種與既有系統的相似性表明,MultiScreen Caco-2 系統可以代替 24 孔系統,作為提高通量和/或自動化體外滲透性篩選實驗的平台。雖然在使用 Caco-2 細胞方法時,實驗室間的差異性可能仍是一個問題,但 Millicell-96 系統可提供實驗室內較低的差異性,以及正確的化合物分類(圖 6)。
結論
本應用筆記中展示的結果證明 Millicell-96 系統提供了一種穩健且可重複的方法來預測人類對藥物類化合物的吸收。該板與廣泛的實驗室機器人相容,可生長穩定、分化的單層,並提供可靠、準確的 Caco-2 滲透性數據。
材料
Network error: Failed to fetch
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?為便利客戶閱讀,此頁面中文以機器翻譯完成。雖然我們已盡力確保機器翻譯的準確性,但機器翻譯並非完美。如果您對機器翻譯的內容不滿意,請參考英文版本。