神經膠質瘤是中樞神經系統最具侵襲性和致命性的實體腫瘤之一。儘管數字驚人,但神經膠質瘤的分子致病機制尚未完全闡明。如今,有幾種方法旨在了解這種疾病的生物學原理,並找出有潛力的標誌物,以提供有效的新療法。本文總結了膠質瘤分類的一些發展以及膠質瘤分層的關鍵分子標記,透過膠質瘤中具有有利和不利預後價值的相關基因清單來強調膠質瘤蛋白質體,並重點介紹膠質瘤腫瘤微環境,這些微環境可能會在開發新型治療策略時提供有用的啟示。
什麼是膠質瘤?
膠質瘤,俗稱腦腫瘤,是中樞神經系統 (CNS) 的實性腫瘤。
腦部腫瘤約佔所有成人癌症的 2%,但在兒童腫瘤中則佔較大比例。神經膠質瘤約佔所有惡性腦腫瘤的 80%,根據起源的細胞類型、分化和惡性程度分類。腦神經膠質瘤在發病年齡、嚴重性等級、組織學特徵、進展能力以及轉移方面都有相當大的差異。根據世界衛生組織(WHO)的分類,膠質瘤分為四個等級。1 級、2 級和 3 級被歸類為低度膠質瘤,而 4 級則被歸類為高度膠質瘤。不幸的是,由於根治性治療的可能性有限,高階層膠質瘤的預後不佳。
Glioma vs. Glioblastoma
最一般的膠質瘤是星形細胞瘤,約佔所有膠質瘤的 50%。4 級星形細胞瘤又稱為膠質母細胞瘤或多形性膠質母細胞瘤 (GBM)。
GBM 是最常見的惡性組織學類型,佔所有膠質瘤的 65%,5 年存活率非常低(少於 5%)。根據血小板衍生生長因子受體 (PDGFR)、神經絲光鏈 (NF-L)、表皮生長因子受體 (EGFR) 和 CD44 等多種生物標誌物的基因表達,GBM 通常可分為三個亞型,即原神經型、經典型和間質型。膠質瘤的前神經至間質轉換與侵襲性表型、不利預後及治療耐藥性有關。
目前的膠質瘤治療現況
膠質瘤在分子層面上是眾所皆知的腫瘤。然而,這些進展尚未轉化為治療效益。儘管我們對於膠質腫瘤分子生物學的認識正在快速擴展,並在某種程度上已經協助我們設計出針對腫瘤的治療方法,例如免疫療法,但我們仍在努力開發有效的治療方法。
典型的神經膠質瘤治療包括手術切除腫塊、放射治療和化學治療。然而,腦神經膠質瘤的復發甚至復發是很常見的,主要是由於其浸潤性生長和高增殖能力所致。
此外,神經膠質瘤的功能異质性不僅由神經膠質瘤細胞的遺傳結構決定,還受微環境驅動的表觀遺傳影響,而這些影響會調節神經膠質瘤細胞的幹性。因此,闡明驅動細胞可塑性的狀態轉換程式和機制,對於克服 GBM 目前的治療限制是至關重要的。
我們必須擴大我們的知識,作為邁向設計實用和安全治療的一步。因此,分子生物標誌物的鑑定對於準確預後和開發神經膠質瘤的關鍵治療靶點而言,無疑是必要且迫切的。
膠質瘤分類
自 2008 年以來,WHO 對腦腫瘤的分類持續演進 (WHO CNS5, 2021)。1 第 5th 版分類強調需要根據組織學和分子遺傳特徵對膠質瘤進行分類,以利臨床診斷和預測結果。隨著 WHO CNS5 2021 版的推出,多種 IHC 診斷和預後標誌物被加入到了膠質瘤的診斷標準中。新的七層膠質瘤分類方法如下所示。
膠質瘤:七層分類法(WHO 2021)1
- 異檸檬酸脫氫酶(IDH1)突變
- 地中海貧血症/精神遲鈍症候群X連鎖基因(ATRX)表現<
- 1p/19q 共缺失
- CDKN2A/B 在 9p21 上的同源缺失
- TERT 基因啟動子突變/EGFR 基因擴增和/或第 7 條染色體獲得和第 10 條染色體喪失 (+7/-10)
- 組合蛋白H3 G34R/V突變
- 組合蛋白H3 K27M/突變
。胶质瘤的分子病理学
针对ATRX、IDH1的突变形式(IDH R132H)和组蛋白H3(H3K27M)的抗体用于检测相应的突变。1p 和 19q 染色體臂缺失的分析是透過多重結合依賴探針擴增 (MLPA) 或較少見的螢光原位雜交 (fluorescent in situ hybridization) 進行。不同形式的膠質瘤之間的區別主要基於形態特徵、突變和染色體畸變,如下所示。
高分級膠質瘤的分子病理
- 甲基化: MGMT、PTEN、RB1、TP53、CDKN2A、PDGFB、EMP3、SOCS1、PCDHGA11、OLIIG1/2
- 染色體畸變:
- 增益: 1q、199、20q
- 損失: 6q、9p、139、14q、229
- 伴隨: +7/-10
- 突變:PTEN、ATRX、TP53、RB1、IDH1/2、NF1、EGFR
- 擴增:MET、EGFR、PIK3CA、PDGFRA、CCND2、MDM2/4
- 缺失:CDKN2A、CDKN2B、CDKN2C、PTEN、RB1、NFKB1A
免疫組織化學(Immunohistochemistry,IHC)在區分不同的腫瘤類型中扮演著重要的角色。 圖1和2展示了IDH1、ATRX和GFAP在不同膠質瘤等級中多重IHC-IF染色的一些例子。
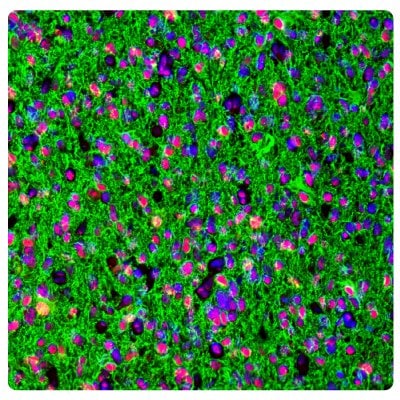
圖 1A.星形細胞瘤中的 ATRX 和 GFAP。星形細胞瘤的多重 IHC-IF 染色顯示腫瘤細胞中的 ATRX(核,紅色)和 GFAP(胞質,綠色)免疫反應,使用 ;抗GFAP抗體。核用 DAPI(藍色)反顯示。

圖 1B.少突胶质细胞瘤中的 ATRX 和 IDH1。無彈性少突胶质细胞瘤的多重IHC-IF染色顯示腫瘤細胞中的ATRX(核,紅色)和IDH1(胞質,綠色)免疫活性,使用抗IDH1抗體。核用 DAPI(藍色)反顯示。

圖 2A.膠質母細胞瘤中的 ATRX 和 GFAP。多形性膠質母細胞瘤的多重 IHC-IF 染色顯示腫瘤細胞中的 ATRX (核,紅色) 和 GFAP (胞質,綠色) 免疫反應。a href="/product/sigma/amab90784「>Anti-ATRX 抗體和Anti-GFAP 抗體。核用 DAPI(藍色)反顯示。

圖 2B.膠質母細胞瘤中的 ATRX 和 IDH1。多形性膠質母細胞瘤的多重 IHC-IF 染色顯示腫瘤細胞中的 ATRX (核,紅色) 和 IDH1 (胞質,綠色) 免疫活性。a href="/product/sigma/hpa001906「>Anti-ATRX 抗體和Anti-IDH1 抗體。核用 DAPI(藍色)反顯示。
區別特徵:成人型與小兒型膠質瘤
WHO CNS5 2021 腦腫瘤分類的一項重要更新,是將瀰漫性膠質瘤區分為成人型與小兒型膠質瘤,兩者對治療的反應和結果都截然不同。
不同形式的膠質瘤之間的區別主要基於形態特徵;然而,IHC 分析在區別不同類型的腫瘤上扮演著重要的角色,尤其是當腫瘤分化不良時。腦神經膠質腫瘤可根據起源細胞類型、分化程度及惡性程度分級。膠質瘤的類型、等級和分子特徵決定診斷和治療方案。根據綜合分子分析,成人的瀰漫性浸潤性膠質瘤依起源、異柠檬酸脫氫酶(IDH)突變、ATRX 和 1p/19q 表達,可分為三個主要群組。
以下說明成人和小兒型瀰漫性膠質瘤的 分類、等級和主要診斷基因。
成人型瀰漫性膠質瘤
- 星形細胞瘤
- ligodendrogliomas
- IDH突變、1p/19q-co-deleted Grade 2,3 IDH1-2, 1p/19q, TERT, CIC, FUBP1, NOTCH1
- IDH 野生型 4 级 TERT、染色体 +7/-10、表皮生长因子受体
兒科型擴散性胶质瘤
- 低分级
- 擴散性星形细胞瘤 ;
- 1級
- MYB-或MYBL1-改變
- Angiocentric Glioma
- 。
- 1級
- ATRX、p53、IDH1 (R132H)、BRAF V600E、H3 K27M
- 1級
- 表皮生长因子受體3擴增,BRAF V600E
- 擴散性星形细胞瘤 ;
- 擴散性低度膠質瘤
- G*
- МАРК
- 擴散性中線膠質瘤
- G*
- H3 K27 變異,PDGFR-a
- 瀰漫性半球形膠質瘤
- 4級
- H3 G34-突變體
- 擴散性小兒型高分級膠質瘤
- G*
- 嬰兒型半球形膠質瘤
- G*
- ALK, ROS1, NTRK1/2/3, 或 MET
許多報告強調成人和小兒膠質瘤的重大差異,主要是基於組織學觀察、頻率、位置和病理譜。2例如,小兒高分化膠質瘤通常發生在成人疾病很少針對的腦部區域。
小兒瀰漫性膠質瘤比成人的更複雜,分子學上也更為不同。小兒神經膠質瘤一般分為低度和高度兩種,其特點是周圍性生長,常有 H3 和 BRAF 基因融合或突變。1
另一方面,在成人原發性膠質母細胞瘤中常見的 PTEN 突变和 EGFR 擴增,在兒童中則較少見。3此外,在成人中,繼發性膠質母細胞瘤很少含有 EGFR 擴增。4
TP53、CDKN2A 和 PIK3CA 的突變在成人和兒童高位膠質瘤中很常見。5此外,血小板衍生生長因子受體-α (PDGFR-α)是兒童高位膠質瘤中局灶擴增的主要靶點,對兒童來說可能是有價值的靶點。6
拷貝數變異的顯著差異區別了兒童和成人膠質母細胞瘤。小兒腫瘤中未發現 IDH1 熱點突變,突顯出與成人繼發性膠質母細胞瘤的分子差異。1q染色體的頻繁增益以及較低頻率的7號染色體增益和10q染色體缺失也明顯區分了兒童和成人的高分化膠質瘤。6
人類蛋白質圖集網站。
轉錄組分析顯示,72% (n=14,370) 的人類基因 (n=20,090) 在膠質瘤中表達。它也顯示有 895 個基因在膠質瘤中表達升高,其中 267 個基因被建議為預後性基因。在這些預後基因中,有 200 個與不利預後有關,67 個與有利預後有關。
在 GBM 中,與不利和有利預後相關的前 20 個重要基因分別列於 Table 1 和 Table 2。對於不利基因,診斷時較高的相對表達水平會顯著降低總生存率。對於有利基因,診斷時相對表達水平越高,總生存率越高。
Figure 3顯示了高分化和低分化膠質瘤中突變基因的不同組成。
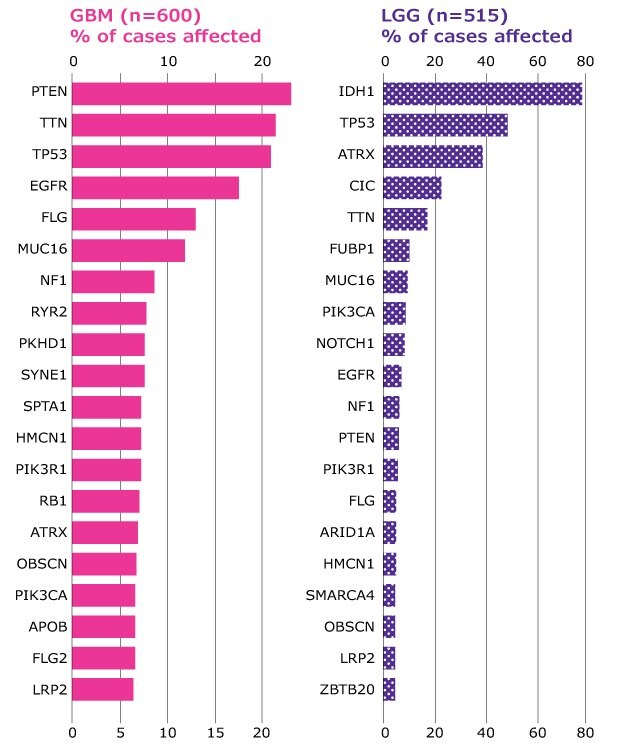
圖 3.高分化和低分化腦神經膠質瘤在突變基因的組成上有所不同。高級 (GBM) 和低級膠質瘤 (LGG) 中最常突變基因的分佈,以佔總病例 (n) 的百分比表示。資料來源 TCGA。
膠質瘤腫瘤微環境
腫瘤細胞與周圍膠質瘤腫瘤微環境(TME)之間的動態溝通在膠質瘤的持續生長、增殖和入侵、存活、迴避細胞死亡、新陳代謝、遷移和轉移中發揮關鍵作用。
膠質瘤的TME是高度異質的,由多種癌細胞和非癌細胞組成,包括內皮細胞(EC)、免疫細胞、膠質瘤幹樣細胞(GSC)和星形細胞,以及細胞外基質(ECM)等非細胞成分。7,8
膠質瘤腫瘤細胞與 TME 之間的細胞間溝通有幾種方式已被記錄在案。9,10
在神經膠質瘤腫瘤微組織中,細胞透過內皮細胞、生長因子、細胞活素、化學因子、單體細胞、巨 噬細胞、肥大細胞、小膠質細胞、T細胞、星形細胞、少突膠質細胞和癌症幹細胞進行溝通。了解動態的膠質瘤腫瘤微環境對於發展新的免疫治療策略是必要的。神經膠質瘤細胞與正常非腫瘤細胞共存。腦神經瘤細胞在缺氧性免疫抑制的TME中增殖,具有異常的血管、豐富而獨特的細胞外基質以及受損的血腦腫瘤屏障。
TME中的四種機制已經成為我們了解腦神經瘤的首要因素,並且對新治療策略的開發至關重要,這些機制包括免疫調節、血管生成、癌症幹細胞和耐藥性。
免疫調節
近年來,免疫治療已成為抗癌治療的主要選擇之一。11腫瘤細胞抑制局部和全身免疫反應的能力,以及騎劫與TME溝通的能力,嚴重限制了治療效果。
免疫細胞構成了神經膠質瘤TME的重要組成部分,因為它們可以達到腫瘤質量含量的50%。
在免疫相關基因中,ADORA2A、CD160、CD276、NRP1和VTCN1在低度膠質瘤中明顯過度表達。在高分化膠質瘤中,VTCN1、BTNL2 和 METTL21B 過度表達,而 CD86、HAVCR2、LAIR1 和 VSIR 則明顯降低。
膠質瘤細胞分泌的細胞因子和趋化因子會誘導免疫抑制細胞(MDSCs、Tregs 和 TAMs)的浸潤,以及髓系細胞獲得親腫瘤表型(M2 表型分化和 PDL-1 及 B7 表達)。
血管生成
膠質母細胞瘤的預後不佳,部分原因也是因為無法成功透過血腦腫瘤屏障給藥。膠質母細胞瘤是高度血管化的腫瘤,而膠質瘤的生長有賴於新血管的形成。血管生成是一個複雜的過程,涉及血管內皮細胞在特定信號刺激下的增殖、遷移和分化。
例如,高位膠質瘤的高代謝需求會造成缺氧區域,而缺氧區域會引發 PLVAP(血腦障壁破壞的血管標誌)的表現和血管生成,導致異常血管的形成和血腦腫瘤障礙。與腫瘤周圍的正常組織相比,膠質母細胞瘤中未成熟血管的標誌物 Endoglin (CD105) 顯著較高。14
膠質瘤癌幹細胞與耐藥性
耐藥性與再發是膠質瘤治療的主要問題,也是造成死亡的主要原因。腦神經膠質瘤的再發主要與腫瘤細胞在初次治療後從原發性腫瘤內和周圍的耐藥癌幹細胞再生的能力有關。膠質瘤癌症幹細胞(GSCs)是高級別膠質瘤中不受控制的細胞生長的主要動力,同時也是治療抗藥性的主要動力。7,15
GSCs透過一套核心的神經發育轉錄因子和癌基因發揮作用。高等級膠質瘤顯示幹細胞的轉錄升高,如ALDH1A1、EZH2、GFAP、SALL4、NANOG和POSTN。分子表面標記如CD133、CD44、A2B5、CD15和CD171也與膠質瘤的再發及膠質母細胞瘤的侵襲性增加有關。
其中一個例子是ChI3L1作為幹細胞狀態的調節器。人類腫瘤的表型可塑性可由上皮到間質轉換(EMT)過程的活化驅動,細胞藉此獲得可塑性並獲得幹細胞的特性。CHI3L1 是一種分泌性蛋白質,可作為幹細胞狀態的調節劑,在神經膠質瘤中高度表達。CHI3L1 在膠質母細胞瘤中被用作入侵、遷移和血管生成的標記。16 圖4顯示了一個用抗CHI3L1抗體對星形細胞瘤進行免疫染色的例子.
。
圖 4A.用抗CHI3L1抗體染色的人類正常皮層組織樣本的螢光免疫組織化學圖片。核被 DAPI(藍色)反顯示。
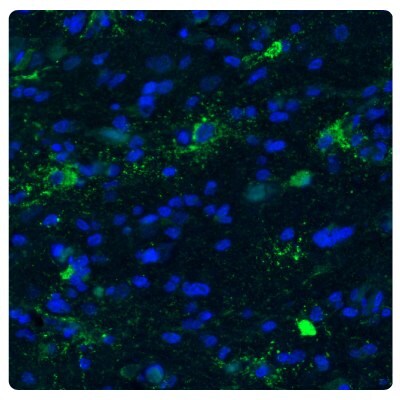
圖 4B.用抗CHI3L1抗體染色的星形細胞瘤樣本的螢光免疫組織化學圖片,顯示強烈的蛋白質表達(綠色)。細胞核以 DAPI 反染色(藍色)。
膠質瘤 TME 標誌
TME,包括髓系細胞(如小膠質瘤和巨 噬細胞)的浸潤,在膠質瘤進程中扮演重要角色。17膠質瘤累積的小膠質細胞/巨噬細胞是一種混合細胞群,具有支持和抗腫瘤的特性,不過支持腫瘤的效應通常佔優勢。
HLA-DRA
向 CD4 陽性 T 細胞呈現抗原的小膠質細胞會表達屬於 HLA II 類蛋白質的 HLA-DRA 蛋白。18 HLA 表達在膠質母細胞瘤中會增加,有證據顯示 HLA 家族可作為治療膠質母細胞瘤的特定分子靶點。19
METTL21B
METTL21B 參與細胞黏附、血管生成和細胞增殖。在蛋白水平上,其表達與神經膠質瘤等級呈正相關。METTL21B 通過介導巨噬細胞從 M1 到 M2 的極化和調節免疫檢查點的表達,促進腫瘤的免疫逃避並影響預後。然而,高水平的 METTL21B 與免疫檢查點阻斷療法的較佳反應有關。20
圖 5顯示膠質母細胞瘤腫瘤細胞中 METTL21B 的高表達,以及活化的小膠質細胞 (HLA-DRA) 數量較對照組增加。

圖 5A.使用 Anti-HLA-DRA 單株抗體(綠色為胞質)和Anti-METTL21B 多株抗體(紅色為核區)對人類正常皮質樣本進行多重 IHC-IF 染色。核用 DAPI(藍色)對照。白色箭頭表示活化的小膠質細胞(HLA-DRA 陽性染色)。
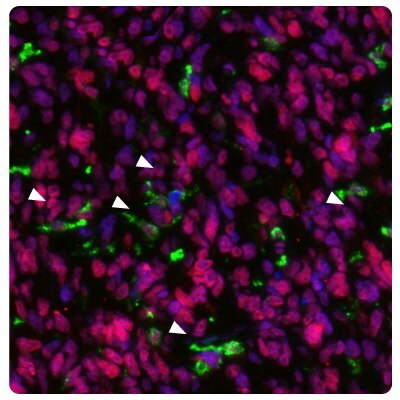
圖 5B.使用 Anti-HLA-DRA 單株抗體(綠色為胞質)和Anti-METTL21B 多株抗體(紅色為核區)對膠質母細胞瘤樣本進行多重 IHC-IF 染色。核用 DAPI(藍色)對照。白色箭頭表示活化的小膠質細胞(HLA-DRA 陽性染色)。
SALL4
靶向膠質瘤 GSCs 是臨床治療膠質瘤的一個極其重要的方面。
轉錄因子 SALL4 參與細胞增殖、凋亡、週期、入侵、演化和耐藥性。SALL4 在膠質瘤中過度表達,並與不良結果相關。21 SALL4 的作用方式是強化 PI3K/AKT 訊號通路(這是調控腫瘤發生的知名通路,在膠質瘤中顯著活化),從而降低腫瘤抑制因子 PTEN 的表達(Liu 2017)。22
圖 6顯示 SALL4 在人類和小鼠組織中的特性,圖 7則顯示 SALL4 在膠質瘤樣本中上調的例子。
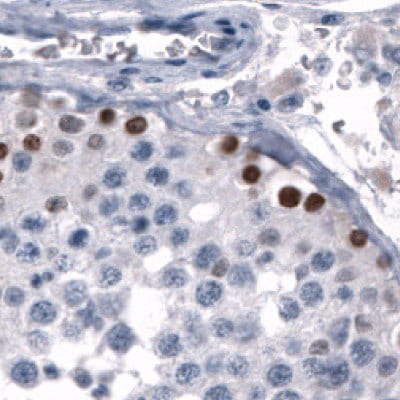
圖 6A.使用Anti-SALL4單株抗體進行免疫組織化學染色,顯示睪丸生殖細胞的核陽性。
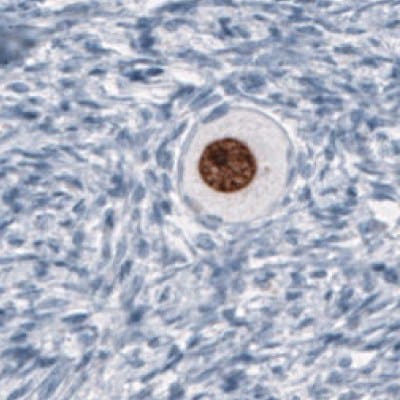
圖 6B.使用Anti-SALL4單株抗體進行免疫組織化學染色,顯示卵母細胞中生殖細胞的核陽性。
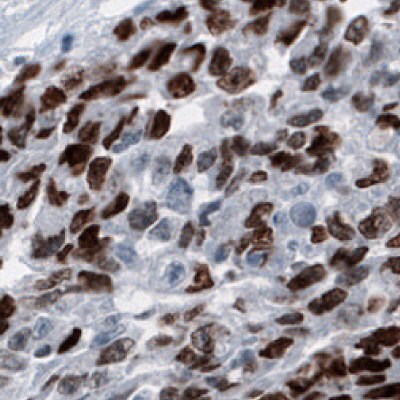
圖 6C.使用Anti-SALL4單株抗體進行免疫組織化染色,顯示胚胎睾丸癌人體組織中生殖細胞的核陽性。
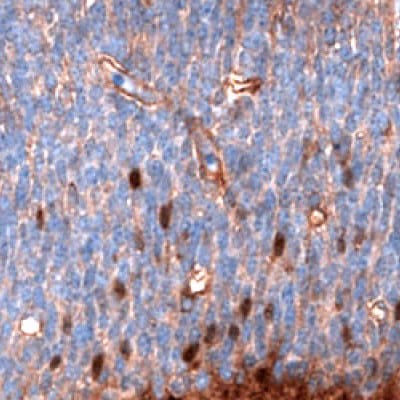
圖 6D.使用Anti-SALL4單株抗體進行免疫組織化學染色,顯示小鼠胚胎E11發育中的腦部細胞亞群的核陽性。
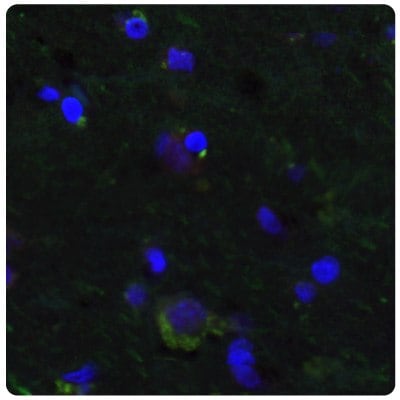
圖 7A.使用Anti-PTEN單株抗體(胞質染色,綠色)對人類正常皮質樣本進行多重IHC-IF染色。核用 DAPI(藍色)對照。
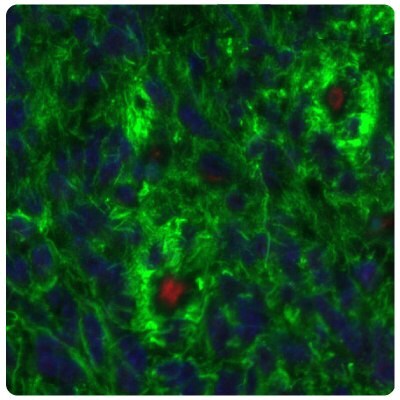
圖 7B.與圖 7A 相比,SALL4 在膠質瘤樣本中上調。使用Anti-PTEN單株抗體(胞質,綠色)對膠質母細胞瘤樣本進行多重IHC-IF染色。核用 DAPI(藍色)對照。
EZH2
轉錄因子 EZH2 在膠質瘤中高度表達,是免疫治療的潛在靶點。EZH2 是一種組蛋白 H3 賴氨酸甲基轉移酶,可透過改變腫瘤抑制基因的表達,促進包括膠質瘤在內的多種人類惡性腫瘤的腫瘤發育。EZH2 在神經膠質瘤中的過度表達與數個免疫檢查點、細胞週期、DNA 複製、錯配修復、p53 信號傳導,以及腫瘤浸潤淋巴細胞。23
ALDH1A3
醛脫氫酶 ALDH1A3 與細胞黏附和腫瘤侵襲有關,是神經膠質瘤 Mes-subtype 的標記。ALDH 是與神經膠質瘤惡性表型相關的癌症幹細胞的標記。在 ALDH 同工型中,ALDH1A3 在高位階膠質瘤中比低位階膠質瘤過度表達,而 ALDH1A1 則在低位階膠質瘤中比高位階膠質瘤過度表達。大多數中間葉亞型有高 ALDH1A3 mRNA 表達,顯示 ALDH1A3 是中間葉亞型膠質瘤的有用標記。24
圖 8顯示不同樣本類型中 EZH2、PARP1 及 ALDH1A3 表達的免疫染色。
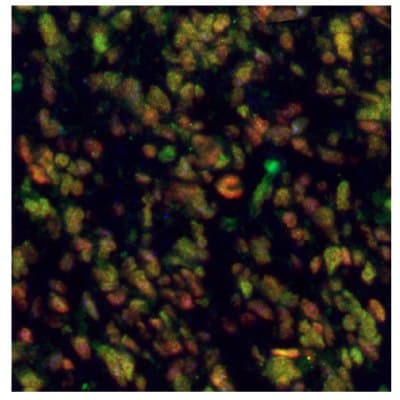
圖 8A.使用抗Anti-ALDH1A3單克隆抗體(胞質,藍色)。
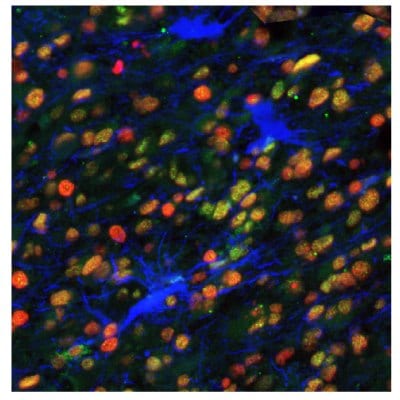
圖 8B.使用the Anti-ALDH1A3 monoclonal(胞質,藍色)抗體。
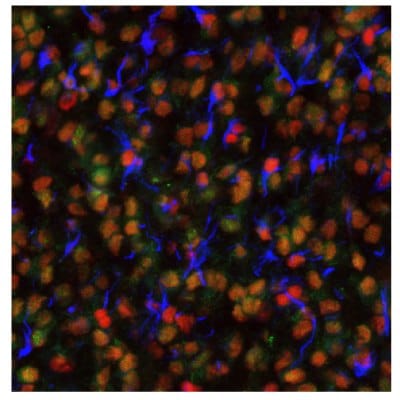
圖 8C.使用the Anti-ALDH1A3 monoclonal(胞質,藍色)抗體。

圖 8D.使用the Anti-ALDH1A3 monoclonal(胞質,藍色)抗體。
SGO2
Shugoshin 2 (SGO2) 在細胞分裂和細胞週期進程中至關重要。SGO2 在神經膠質瘤細胞增殖中扮演重要角色。資料顯示,SGO2 的表達與人類神經膠質瘤的 WHO 分級呈正相關。25
圖 9顯示人類正常皮層和神經膠質瘤樣本中 EZH2 和 SGO2 表達的免疫圖譜。

圖 9A.使用抗SGO2多克隆抗體(核區,洋紅色)對人類正常皮質樣本進行多重IHC-IF染色。
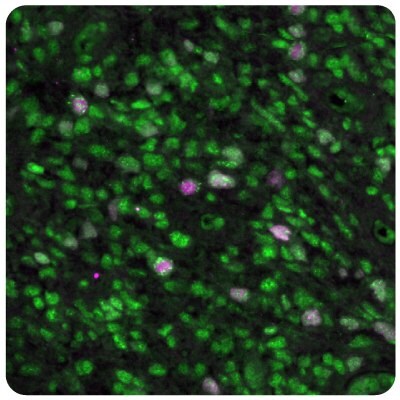
圖 9B.使用抗SGO2多克隆抗體(核區,洋紅色)對人類膠質母細胞瘤樣本進行多重IHC-IF染色。
表 3 顯示針對膠質瘤 TME 標記的單株抗體比較。
用於靶向膠質瘤標誌物的可靠抗體
Prestige Antibodies® powered by the Human Protein Atlas project 提供超過 21,000 種針對大部分人類蛋白質的一抗。
Prestige抗體®多克隆抗體是在人類蛋白質圖集項目中開發的兔多克隆一抗。人類蛋白質圖集門戶網站提供來自 44 個正常組織和 20 個癌症組織的 IHC 特性資料。
Prestige Antibodies® monoclonals 是針對許多精心挑選的靶點開發的小鼠單克隆一抗。克隆抗體僅能辨識獨特的非重疊表位和同類型。它們也有25 µL和100 µL的單位大小。
參考資料
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?