
生物大分子(例如蛋白質或 mAbs)本質上是由大量個別弱作用力所穩定的微妙結構。在製造和處理過程中,通常需要較長的保存期限和各種應力,因此需要使用輔料來管理,以製造出穩定且安全的藥物產品。上述的輔料不僅有其特定的功能,也可能具有獨特的品質屬性,對蛋白質的穩定性有正面的影響。
蛋白質長期穩定性的關鍵因素
單株抗體 (mAbs) 和源自血漿的蛋白質產品可用於治療各種急性和慢性疾病。對於典型的藥物產品而言,其配方可使保質期達到兩年,但基於蛋白質的本質,這可能是一項極具挑戰性的任務。蛋白質在保質期內所經歷的熱力學波動可能會導致蛋白質的折疊錯誤,進而形成聚集核並喪失功能,這兩種情況都會影響療效。由於聚合有可能引發免疫反應,因此也可能導致病患的安全問題。
除了蛋白暴露於熱力學波動之外,抗體在玻璃瓶中的儲存也會因吸附等表面效應而導致聚集。蛋白質可能呈現兩親特性,疏水胺基酸殘基較可能位於蛋白質的核心,而表面的親水胺基酸殘基則有助於蛋白質的溶解性。蛋白質與疏水性界面(包括液-固(例如小瓶的玻璃壁)、液-氣或液-冰)的互動會導致吸附過程。結果,蛋白質會形成高濃度的蛋白質膜,蛋白質也可能在此過程中發生部分折疊。
製造條件和藥品處理
除了蛋白質的特性和在玻璃瓶中長期儲存所產生的挑戰外,製造條件和藥品處理也會影響穩定性。
- pH是藥物配方中的關鍵因素,必須考慮它對蛋白質穩定性的影響。
- 在純化或填充和精加工過程中,通過管路泵送料流會對藥物造成機械應力。
- 在運輸過程中搖晃藥瓶,以及在室溫下儲存藥物(例如在用藥前),都會影響穩定性。
使用適當的輔料有助於保證蛋白質藥物的長期穩定性、確保可製造性,以及支持安全處理。
防止機械應力的穩定劑:表面活躍劑和環糊精
為了防止因抽吸或震動而引起的表面或機械聚集,可以使用表面活躍劑或環糊精。
如上所述,表面誘導的蛋白質聚集是由蛋白質吸附到疏水性介面(例如液-氣和液-冰介面)所引發的。由於吸附過程而形成的高度濃縮蛋白質膜,會在隨後的機械應力(如攪拌)作用下形成蛋白質顆粒。表面活性剂可通过两种不同的机制防止这种聚集(图 1)。
表面活性剂是表面活性物质,可与蛋白质竞争这些界面上的吸附。表面活性剂要么占据表面的空间,阻止蛋白质吸附,要么取代吸附的蛋白质,使其返回液相,抑制蛋白质膜的形成,降低聚集的可能性(图 1B)。
表面活性剂还可以通过直接与目标蛋白质相互作用来提高蛋白质的溶解度,起到伴侣的作用(图 1C)。有些抗體可能會在水溶液中暴露出疏水斑塊;表面活化劑可以在這些結構區域與抗體結合,使它們免受親水環境的影響。通過覆蓋蛋白質表面的疏水斑塊,表面活化劑可以防止抗體吸附在表面上或與其他抗體形成聚集核。
A:蛋白質對界面的吸附
B:競爭性表面吸附
C:界面活性劑 - 蛋白質結合


圖 1。加入表面活化劑後,可透過兩種機制防止蛋白質吸附在介面上,進而形成蛋白質膜並繼而聚集 (A):透過表面活性劑分子覆蓋疏水介面的競爭性表面吸附 (B) 或表面活性劑直接與蛋白質分子結合,使其溶解在液相中 (C)。
Polysorbate 20 和 80 是常用的表面活性剂,在 90% 已批准的单克隆抗体制剂中都有使用。1 根据使用的赋形剂和要配制的蛋白质,使用的浓度为 0.01% 和 0.1%。
儘管環糊精不能歸類為表面活性剂,但這些分子已被證明可穩定蛋白質,使其免受表面和攪拌引起的應力影響,濃度低至 0.35% (2-Hydroxypropyl)-β-cyclodextrin 是一種環狀寡糖,由七個 α-glucopyranose 單體組成,形成一個具有親水性表面和疏水性空腔的中空截斷圓錐體。
在一項強制降解研究中,各種蛋白質暴露在攪拌、搖動、蠕動泵送和冷凍/解凍壓力下。圖 2 顯示高純度的聚山梨醇酯 20 與聚山梨醇酯 80、poloxamer 188 以及環糊精可以防止所有應力類型所造成的蛋白質聚集,這些應力類型都是應用於引發表面或攪拌所造成的蛋白質聚集。100% 的單體回收率和低渾濁度證明了成功的穩定效果。對於表面活化劑,使用一般濃度即可達到此效果;對於環糊精,使用 0.35% 的濃度即可達到此效果。
剪切應力下的 ImAbE
。搖晃應力下的黴菌
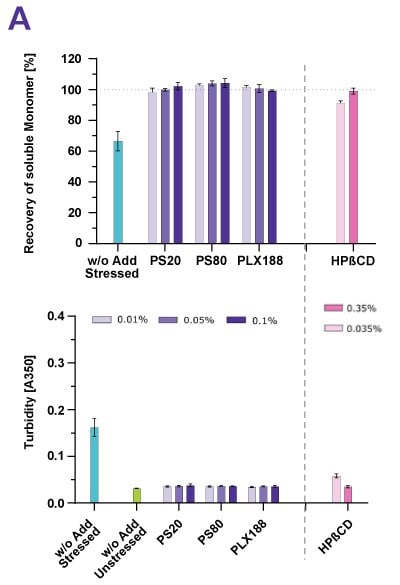

圖 2. 無論蛋白質處於剪切應力(A)或振動應力(B)下,環糊精(HPβCD)都能有效穩定 mAb。
A:不含輔料
B:優先排除
C:優先綁定
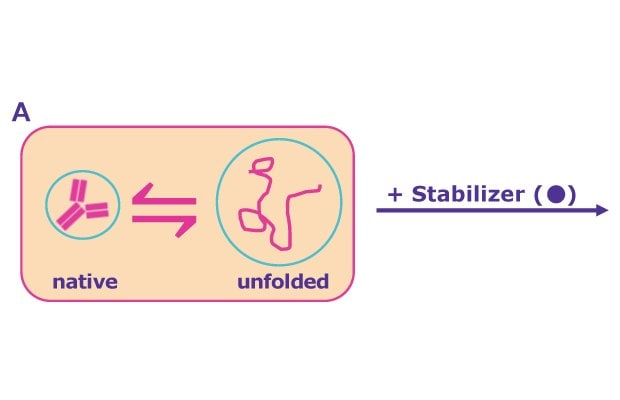

圖 3。在溶液中,原生折疊蛋白質與(部分)未折疊蛋白質狀態之間存在動態平衡 - 後者容易發生聚集 (A)。穩定劑可透過優先排除蛋白質表面的輔料和水化蛋白質分子,將平衡轉向原生折疊狀態 (B)。其他穩定劑的作用方式則是與蛋白質的部分展開狀態優先結合,防止聚集、進一步降解及之後重新折疊 (C)。
有幾種氨基酸可以用來穩定蛋白質。所有氨基酸中都有的甘氨酸骨架具有眾所周知的穩定特性。精氨酸包含一個胍基,它帶有分散的正電荷,因此,與芳香族殘基的互作有助於目標蛋白質的溶解或降低配方的黏度。組氨酸是另一種穩定胺基酸,常用於單株抗體製劑的緩衝劑。
糖類和糖醇可作為蛋白質的穩定劑,以抵抗熱效應和熱力效應,包括蔗糖、曲哈糖和肌醇。為了證明糖類的穩定作用,我們將多種抗體藥物產品(包括一種融合蛋白和兩種 ADC-mimics)暴露於強制降解條件下。為了確保結果的可比性,選擇的溫度比每種蛋白質的個別熱轉換中點低 10 °C。檢驗樣本的渾濁度、單體含量、單體純度、聚集物以及目視檢查。圖 4A-D 顯示抗體 Denosumab 的範例資料集。
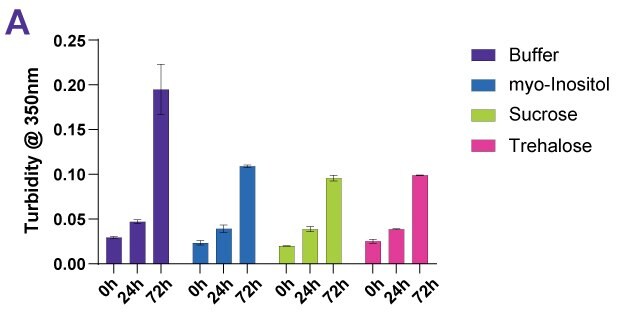
圖 4A.以混濁度測量 Denosumab 強制熱降解後不同蛋白質穩定劑的效果。

圖 4B.根據單體含量測量 Denosumab 強制熱降解後不同蛋白質穩定劑的效果。
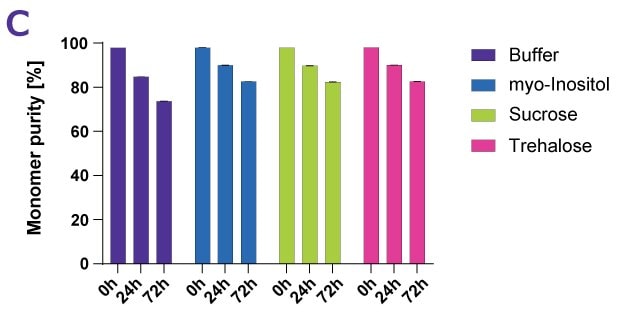
圖 4C.根據單體純度測量 Denosumab 強制熱降解後不同蛋白質穩定劑的效果。

圖 4D.Denosumab 強制熱降解後不同蛋白質穩定劑的效果(以聚集體百分比測量)。
表 1 顯示糖醇肌醇與蔗糖和曲哈糖的蛋白質穩定效果相當。
| Analytics Readout | Entanercept | Denosumab | Tocilizumab | ADC-1 | ADC-2 |
|---|---|---|---|---|---|
| 目視檢查 | - | - | - | - | - |
| - | - | - | - | - | |
| - | - | - | - | - | |
| - | o | - | - | - | |
| SEC | - | - | - | - | - |
除了在傳統液體配方中的應用外,蔗糖和曲哈糖還可在凍乾過程中用作穩定劑。這些糖與山梨醇或甘露醇等膨脹劑一起形成玻璃基質,可透過水份置換和玻璃化作用穩定蛋白質。在乾燥過程中,穩定劑可取代水與蛋白質形成氫鍵;因此,即使在沒有水的情況下,原生結構仍可維持。玻璃化可透過形成堅硬的玻璃基質來穩定分子。在此基質中,熱動力平衡動力不再重要,蛋白質則以動力方式穩定。雖然蔗糖和曲哈糖等糖類可提供相當高的玻璃轉換溫度,但也可使用其他輔料來強化固定蛋白質的氫鍵。
山梨醇和甘露醇是常用的膨脹劑。除了作為蛋白質穩定劑之外,這些膨脹劑還能減少乾燥時間,使凍乾過程更有效率。視製劑的凍乾方式而定,這些膨鬆劑也可作為溶解促進劑。但應注意的是,膨脹劑通常是塑化劑,會降低製劑的玻璃轉換溫度。為使凍乾配方穩定,必須將其儲存於低於玻璃轉換溫度約 30 °C 的溫度下。在製劑開發過程中,必須最佳化凍乾製程以及所使用的外用配料的選擇和用量,才能製造出穩定的製劑。
原料的純度和品質可降低藥物開發的風險
最終的藥物產品必須符合高安全標準,並符合眾多法規。例如,藥物產品中的生物負荷和內毒素含量有嚴格的限制。在受控條件下生產的高品質原料,可進一步降低不符合安全要求的風險。
例如,聚山梨醇酯容易氧化和水解;由此產生的降解產物包括脂肪酸和過氧化物,會對蛋白質的穩定性造成負面影響。目前業界的趨勢是開發更穩定的表面活性剂,並最終取代聚山梨醇酯。雖然這些新型解決方案仍在開發中,但建議使用 polysorbates in their highest purity grade, if poloxamer 188 or cyclodextrin cannot be considered.
蔗糖的其他品質屬性也很重要。某些批次的蔗糖可能含有納米顆粒雜質,這些雜質可能會被誤認為蛋白質聚集體而導致錯誤的分析結果。此外,這些奈米級雜質還會形成蛋白質聚集核。在受控環境中製造減少奈米微粒雜質的數量,並將真正或分析上錯誤的蛋白質聚集風險降至最低。
當甘氨酸以粉末的形式使用時,它有很高的結塊傾向;所產生的甘氨酸餅狀物很難掰開,使得其製造過程相當麻煩。 粒化甘氨酸大大降低了結塊傾向,並提供更好的流動性和快速溶解行為,使其更適合在生物製程中使用。
擴大輔料組合的需求
在製造和最終使用過程中,藥物產品會接觸到許多可能導致不穩定和聚集的因素。
除了可能導致蛋白質聚集的不同機制之外,抗體藥物產品也可能具有高度的多樣性,在疏水性、電荷分佈和糖基化方面各不相同。雖然聚山梨醇酯 20 和 80、poloxamer 188 以及環糊精可以保護蛋白質不受機械壓力的影響,但很難可靠且有信心地預測哪一種輔料是特定蛋白質的最佳選擇。同樣的道理也適用於對熱及熱力學因素有穩定作用的輔料。
我們的隨選網路研討會「
Network error: Failed to fetch
參考資料
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?為便利客戶閱讀,此頁面中文以機器翻譯完成。雖然我們已盡力確保機器翻譯的準確性,但機器翻譯並非完美。如果您對機器翻譯的內容不滿意,請參考英文版本。