製備和稀釋Percoll的儲備溶液
要使用Percoll製備梯度,必須先用生理鹽水或細胞培養液調整Percoll(未稀釋)的滲透壓,使Percoll與生理鹽溶液等張。將 9 份 (v/v) 的 Percoll 加入 1 份 (v/v) 的 1.5 M NaCl 或 10 倍濃縮的細胞培養液,是製備等張性 Percoll (SIP) 儲存溶液的簡單方法。最後可加入鹽或蒸餾水調整至所需的滲透壓。由於細胞密度取決於滲透壓(圖 6),因此應使用滲透壓計定期檢查儲備溶液的滲透壓,以確保不同實驗間的重現性。對於在鹽分存在下會聚集的亞細胞微粒,可將 9 份 (v/v) Percoll 加入 1 份 (v/v) 2.5 M sucrose 製成等張性 Percoll (SIP) 原液。

其中:
Vx = 稀釋培養基的體積 (mL)
Vo = 未稀釋 Percoll 的體積 (mL)
ρo = Percoll 的密度 (1.130 + 0.005 g/mL*)
ρ10 = 密度為 1.5 M NaCl = 1.058 g/mL(其他鹽的密度略有差異)
2.5 M sucrose 的密度 = 1.316 g/mL(其他添加劑的密度略有差異)
ρi = 生成的 SIP 溶液的密度(g/mL)
因此,對於生理鹽水中的 SIP,ri = 1.123 g/mL,蔗糖中的SIP,ri = 1.149 g/mL,假定ro = 1.130 g/mL。
*分析证书上注明的准确密度。
将等渗Percoll(SIP)储备溶液稀释到较低密度
等渗Percoll(SIP)储备溶液只需通过添加0.15 M NaCl(或正常強度的細胞培養液)來進行細胞工作,或在處理亞細胞微粒或病毒時加入 0.25 M 蔗糖。
以下公式可用於計算獲得所需密度溶液所需的體積。

其中:
Vy = 稀釋介質的體積(mL)
Vi = SIP 的體積(mL)
ρi = SIP 的密度(g/mL)
ρy = 稀釋介質的密度,單位 g/mL
(密度為 0.15 M NaCl 的密度為 ~1.0046 g/mL)*
(0.25 M sucrose 的密度為 ~1.032 g/mL)*
ρ = 生成的稀釋溶液的密度(g/mL)
示例: 要將 55 mL 的 SIP 稀釋到最終密度為 1.07 g/mL,請確定所需的 0.15 M NaCl 的量。

上述公式有助於達到與實際密度非常接近的密度。但是,稀釋介質的體積和密度的輕微變化會影響最終密度。要確定實際密度,我們建議使用密度計或折射計測量 Percoll 溶液的最終密度。
註:圖 5 中的圖表也可用作用 0.15 M 生理鹽水或 0.25 M 蔗糖稀釋 SIP 所產生溶液密度的經驗指南。此圖指的是 SIP 的稀釋,其中 SIP 是 90% (v/v) 未稀釋 Percoll,透過加入 10% (v/v) 生理鹽水或蔗糖進行滲透調整。因此,為避免混淆,最好使用工作溶液的實際密度(或說明 % SIP),而不是以等滲透生理鹽水或蔗糖中 Percoll 的百分比來表示溶液。這一點在使用下文所述的一步法稀釋程序時尤為重要,該程序是用蒸餾水稀釋 Percoll(未稀釋)加濃縮鹽或蔗糖至最終體積,從而獲得已知密度的工作溶液。

圖 5.用等滲鹽水或蔗糖溶液稀釋等滲 Percoll (SIP) 儲備液。Po 為 Percoll(未稀釋)的密度。SIP 的製備方法如前所述。所示校準線僅供參考。如需精確的密度測量,請參考文中所給公式。
稀釋 Percoll 的一步式步驟
Percoll(未稀釋)可直接稀釋成已知密度的最終工作溶液,步驟如下。在量筒中加入 1.5 M NaCl 或 2.5 M 蔗糖至最終所需容量的 1/10(例如 100 mL 工作溶液為 10 mL)。再加入所需數量的 Percoll(未稀釋),計算公式如下。用蒸餾水補充至最終容量。

其中:
Vo = Percoll (未稀釋) 的體積 (mL)
V = 最終工作溶液的體積 (mL)
ρ = 最終溶液的期望密度 (g/mL)
ρo = Percoll (未稀釋) 的密度 (g/mL)
(分析證書)br> ρo = Percoll 的密度(未稀釋)(g/mL)
(確切密度的分析證書)
ρ10 = 1.5 M NaCl 的密度 = 1.058 (g/mL)
(其他鹽的密度略有差異)
2.5 M sucrose 的密度 = 1.316 (g/mL)
(其他添加物略有差异)
示例: 在 0.15 M NaCl 中配制 100 mL 密度为 1.07 g/mL 的 Percoll 工作溶液。在 10 mL 1.5 M NaCl 中加入

上述公式有助於達到接近實際所需密度的密度。但是,稀釋介質的體積和密度的輕微變化會影響最終密度。
我們建議使用密度計或折射計測量 Percoll 溶液的最終密度,以確定高度精確的密度。
將Percoll稀釋到所需的滲透壓
為了使等滲Percoll適用於大多數哺乳動物細胞,通常用1份1.5 M NaCl或2.5 M蔗糖溶液稀釋9份Percoll(未稀釋)。然後,再根據需要使用生理緩衝液進一步稀釋此等張Percoll (SIP) 儲備液。然而,儘管這個程序已被證明是成功的,但卻相當簡單,而且沒有考慮到固態矽膠粒子存在的影響(即 100 mL 的 Percoll 儲備液含有一定體積的固態矽膠,使得總水容量小於 100 mL)。由於二氧化矽所佔的體積,漿液中的電解質有效濃度比生理鹽溶液中的高,以這種方式製成的 SIP 將會是高滲透性的。
Vincent和Nadeau(555)優雅地討論了這個問題,並描述了一個等式,可用於計算為獲得任何所需滲透率的SIP,應在一份10×濃度的生理鹽緩衝液中加入多少份Percoll。作者確定了二氧化矽佔 Percoll 儲備溶液總體積的比例,進而確定了水溶液與 Percoll 儲備溶液總體積的比例。
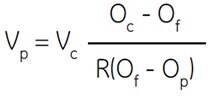
其中:
Vp = 要加入的 Percoll 份數
Vc = 要加入的溶質濃縮物(例如 1.例如:1.5 M NaCl)的份數
Oc = 濃縮溶質的滲透率(例如:1.5 M NaCl = 2880 mOsm)
Of = 所需的滲透率
R = 水容量與 Percoll 總容量的比率(NaCl 通常 = 0.85,蔗糖通常 = 0.80 for sucrose)
Op = 未稀釋的 Percoll 的滲透率(分析證書)
這個等式中的關鍵變數是 R,它是 Percoll 溶液實際水容量的量度。R 值是 Percoll 粒子所佔流體力學體積的函數。反過來,這也是介質離子強度的函數;也就是說,當離子強度增加時,水動力體積就會減少。因此,1.5 M NaCl 和 2.5 M sucrose 的 R 值是有差異的。
若要獲得滲透率 = 320 mOsm/kg H2O 的 SIP,使用 1.5 M NaCl(即 10 倍濃縮生理鹽水)進行調整:

假設:
2880 = osmolality of 1.5 M NaCl
(10×濃生理鹽水)
20 = 未稀釋的 Percoll 的滲透壓
因此,要獲得 320 mOsm/kg H2O 的 SIP,需要在 1 份 1.5 M NaCl 中加入 10 份 Percoll。
渗透压对细胞和亚细胞颗粒表观浮力密度的影响
Percoll的渗透压非常低,有助于研究分离介质渗透压与颗粒表观浮力密度之间的相互关系。圖 6 顯示在滲透壓為 200、300 和 400 mOsm/kg H2O 的 Percoll 梯度中將大鼠肝臟肝細胞分組的效果。細胞的表觀浮力密度會隨著滲透壓的增加而增加,這是由於細胞中的水分被移除所致。線粒體(圖 7)和溶酶體(表 1)也有相同的效果。即使滲透壓發生微小變化,這些細胞器的表觀浮力密度也會發生很大變化。因此,在生理滲透壓下,Percoll 梯度上所記錄到的顆粒實際浮力密度,比在蔗糖或其他離心媒體上所記錄到的顆粒浮力密度,更可能與活體中的浮力密度相符。

圖 6.在自行產生的 Percoll 梯度(8 mL 溶液,密度為 1.065 g/mL)上分離大鼠肝臟肝細胞(35 × 106 個細胞,體積為 2 mL)。Percoll溶液的滲透壓可藉由加入NaCl至200 mOsm、300 mOsm及400 mOsm而改變。在 Beckman 轉盤 30.2 中以 35 000 × g 離心 15 分鐘,溫度為 4 °C。使用密度標記珠(第 23 頁)確定密度梯度(27,經作者和出版商允許轉載)。

圖 7. 在等滲緩衝液(紅色)和含 17.5% 白蛋白的緩衝液(綠色)中培養後,大鼠肝臟細胞線粒體的密度分佈。在 Beckman 65 轉盤(23° 角)中以 40 000 × g 離心 30 分鐘(59,經作者和出版商允許轉載)。
Osmolality of medium (mOm/L)< | Albumin % | |||
|---|---|---|---|---|
| - | 8.5 | 284 | 1.045 | |
| 2.5 | 8.5 | 288 | 1.058 | |
| 5 | 8.5 | 292 | 1.074 | |
| 7.5 | 8.5 | 300 | 1.078 | |
| 10 | 8.5 | 310 | 1.091 | |
| 20 | 8.5 | 374 | 1.110 | |
| 30 | 8.5 | 503 | 1.148 | |
| 40 | 8.5 | 800 | 1.177 | |
從密度為1.0至1.05 g/mL的Percoll/0.25 M蔗糖梯度中回收大鼠肝細胞的溶酶體部分,並在表中所述的培養基中於37 °C培養1 h。然後在 Percoll/0.25 M sucrose 梯度中重新測定浮力密度(27,經作者和出版商允許轉載)。
影響梯度形成與形狀的因素
雖然在 0.15 M NaCl 的存在下,Percoll 顆粒的水合體積比在 Percoll/0.25 M 蔗糖中的小,但由於 Percoll 在生理食鹽水中的黏度較低,因此顆粒的沉降速度較快。因此,當Percoll與最終濃度為0.15 M的生理鹽水或相等離子強度的組織培養液做等滲時,它會比等滲的Percoll溶液與最終濃度為0.25 M的蔗糖做等滲時快約2到3倍,形成自我產生的梯度。
離心和時間是相互關聯的,因為是總的(g力)×(時間)決定了梯度的形狀。在角頭轉子中,0.15 M生理鹽水中的Percoll應至少使用約10 000 × g,0.25 M蔗糖中的Percoll應至少使用約25 000 × g來自生梯度。如圖 8所示,在給定條件下,轉子幾何形狀對梯度形狀有明顯影響。當角度接近垂直時,梯度形成的路徑長度變短,梯度形成的速度變快。 圖9和圖10表明,Percoll的初始濃度對梯度形成的形狀也有一定的影響。

圖 8.轉子角度對 Percoll 梯度發展的影響。起始密度為 1.065 g/mL in 0.15 M NaCl。運轉條件:30 000 × g 14 分鐘。顏色線指彩色密度標記珠(45,經作者和出版商允許轉載)的位置。
在垂直轉子中進行離心會非常快速地形成Percoll梯度。Care must be taken, however, to ensure that the compacted pellet of Percoll which may be formed under high speed centrifugation conditions does not contaminate the gradient during fractionation.
The use of swinging bucket rotors for self-generation of gradients is not recommended, due to the long path length and unequal g-force along the tube.然而,Jenkins 等人(個人通訊和參考資料 87)報告了使用這些類型的轉子進行肝臟細胞器亞細胞分組的一些優點。
Zonal轉子可用於原位形成Percoll 梯度。在Zonal轉子中形成的梯度與在角頭轉子中產生的梯度具有相同的特性。由於樣品體積較大,建議在區域轉子中進行放大之前,先根據經驗確定非區域轉子中的分離條件。
當開始使用自製梯度時,建議使用彩色密度標記珠(第22頁)進行模型實驗,在已知條件下產生一系列標準曲線,這些曲線具有角頭轉子的特徵,可用於隨後的實驗。

圖 9.使用彩色密度標記珠顯示梯度形狀。由 0.15 M NaCl 中等容 Percoll 原液的 90% 至 20% 所形成的梯度。運轉條件 23° 角頭轉子 30 000 × g,15 分鐘。

圖 10.使用彩色密度標記珠顯示梯度形狀。Percoll 稀釋如圖 9,運轉條件:23° 角頭轉子,60 000 × g,15 分鐘。較大的 g 力會形成較陡的梯度。
非連續(步進)梯度
非連續梯度具有極大的靈活性和易用性。通常,只需一墊 Percoll 或一個步驟,就能達到極佳的富集或解析目標細胞類型的效果。例如,使用非連續梯度可以富集大部分血細胞(圖 11)。

圖 11.用 Percoll 中間斷密度離心法分離淋巴細胞和單核細胞。將在 Ficoll-Paque™ 上分離的 1.5 至 2.0 × 107 PBMC(外周血單核細胞)混入 11.25 mL 的 Percoll 中,在含有 1% HEPES 緩衝液的 Hanks BSS 中(密度 = 1.080 g/mL),並在圖中所示的步驟(69,經作者和出版商允許轉載)下方進行底層分離。
為了形成不連續的梯度,如第 12 頁所述,將 SIP 稀釋為一系列不同密度的溶液。然後將不同密度的溶液按密度順序小心地分層,從試管底部密度最大的溶液開始。最方便的方法是使用移液管或裝有寬孔針的注射器。重要的是要讓儀器的尖端緊貼管壁,剛好高於液體表面,以避免「飛濺」和在界面上混合。
離心是在相對溫和的條件下進行,例如在台式離心機中以 400 × g 離心 15 到 20 分鐘。這些溫和的條件會使細胞在相關介面形成等離子帶。
連續線性和非線性梯度
連續梯度的特點是從管頂到管底密度的平滑變化。非連續漸層沒有明顯的介面,連續漸層可被視為有不定數量的介面。
為了形成這樣的梯度,首先稀釋 SIP,在所需範圍的極限產生兩種已知密度的溶液,然後用雙室梯度製造器混合。
根據所用管道的相對直徑,將單通道蠕動泵與梯度混合器結合使用,可以產生線性、凸形和凹形梯度。從梯度的頂部到底部,可形成非常窄的密度範圍,以達到最大的活細胞解析度。較重的細胞通常會沉澱,而無法存活的細胞則會出現在梯度的頂端。例如,如果梯度底部的密度不超過 1.08 g/mL,紅細胞就會沉澱。密度標記珠可在含有與樣品管中相同梯度的試管中作為外部標記。
實現分離所需的離心條件與非連續梯度相同。在連續梯度上進行分離的例子包括純化Leydig細胞、泌乳細胞、骨髓細胞、腸上皮細胞、海洋微藻和葉綠體。
預製的自製梯度
用離心法預製梯度可以方便地替代使用梯度製造器或泵。如前所述,Percoll在受到很大的g力(即> 10 000 × g)時會沉澱。在預先製作梯度時,SIP 會稀釋至需要最大解析度範圍的中間密度。在兩個離心管中注入梯度材料(一個用於實驗,另一個含有密度標記珠)。第二支离心管既可作为平衡管,也可作为监测梯度的外部方法。試管在角頭轉子中離心(例如 30 000 × g 15 分鐘),梯度在起始密度周圍等距形成(圖 4)。梯度的相對 「平坦 」區域應包含目標細胞最大解析度所需的範圍。這可以通過觀察含有密度標記珠的試管中梯度的形狀來確認。隨著時間的推移,梯度會逐漸變陡。
在形成梯度後,可在 400 × g 下低速離心 15 到 20 分鐘,以完成細胞的等離子帶化。如果需要估計細胞密度,可在含有密度標記珠的試管上分層放置與細胞懸浮液體積相等的試管。這可作為估計細胞密度的方法,也可作為平衡。
在 原位
亞細胞顆粒和病毒的沉降係數通常太低,無法在低g力下在預先形成的梯度上形成帶狀。因此,將生物顆粒懸浮液與 Percoll 混合,並在原位形成的梯度上進行分帶通常很方便。離心形成的 Percoll 梯度是穩定的(即在高速離心過程中會持續變化)。膠體的沉降速度很慢,足以讓 "S "值為 > 60S 的小病毒和細胞器在原位形成梯度時形成帶狀。
原位形成梯度的常用方法是製備 SIP,使用 9 份 Percoll 對 1 份 2.5 M 蔗糖。然後使用 0.25 M 蔗糖將 SIP 稀釋至所需密度。(雖然蔗糖通常用來製作原位梯度,但也可以使用細胞培養基)。直接將樣品與梯度材料混合時,對 Percoll 溶液整體密度的影響可根據第 13 頁的公式計算。當需要準確測量顆粒的浮力密度時,將樣品與梯度材料預先混合是很方便的。然而,將實驗樣品分層放置在梯度材料上可能會更好,尤其是在希望將細胞下的顆粒與可溶性蛋白分離的情況下。
離心必須在角頭轉盤中進行。使用含有密度標記珠(Density Marker Beads)的天平管代替實驗樣本來監測梯度。應先進行類似第 22 頁所述的適當模型實驗,以確定所用轉子的梯度形成特性。
Percoll 梯度的最大樣品載量
目前還沒有標準規範在 Percoll 梯度上可以分離的細胞或亞細胞材料的最大數量。對於亞細胞分離,在 10 mL 梯度材料上 0.5 mL 的樣品容量中,1 到 5 mg 蛋白質的總載量就可以成功純化(Pertoft,個人通訊)。
標准 Percoll 梯度條件的模型實驗
離心過程中形成梯度的確切形狀和範圍受所用轉子的型號和角度以及離心管尺寸的影響。以下實驗旨在讓您針對特定轉子和試管建立一系列梯度曲線,並可作為日後所有實驗的參考。
選取的範例為 10 mL 梯度,但也可擴大適用於更大尺寸的試管。
- 將 49.5 mL Percoll 與 5.5 mL 1.5 M NaCl 混和,製成 SIP。
- 將步驟 1 中的 SIP 與 0.15 M NaCl 混和,製成一系列 10 mL 的實驗樣品(離心管總容量 = 13.5 mL),如下表所示:
- 將 49.5 mL Percoll 與 5.5 mL 1.5 M NaCl 混和,製成 SIP。
| Tube No. | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Percoll (SIP) (mL) | 10 | 9 | 8 | 7 | 6 | 5 | 4 | 3 | 2 | 1 |
| 0.15 M NaCl (mL) | - | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
- 根據包裝中提供的說明,在每支試管中加入 10 μL 每種密度標記珠的懸浮液。
- 平衡試管並蓋上管蓋,倒置數次混勻。
- 將試管放入角頭轉子中(如果只有 8 個空位,可省略試管 1 和試管 10)。
- 以 30 000 × g 離心 15 分鐘。
- 小心取出試管,使用毫米圖紙測量每條帶距離試管底部的距離,最接近的距離為 0.5 mm。
- 使用每個 Marker Bead 的精確浮力密度校準每條帶,為每個試管繪製梯度形狀圖。
- 倒轉重新混合每支試管的內容物,並重複離心,這次使用 60 000 × g 離心 15 分鐘。
- 測量梯度並繪製結果,如同之前一樣。圖 9和10是使用 Percoll 在 0.15 M NaCl 中產生的一系列曲線的典型示例。
可以使用 Percoll 在 0.25 M 蔗糖中重复该实验;在这种情况下,运行条件应为 50 000 × g 25 分钟,然后 100 000 × g 25 分钟。
要將每分鐘轉數 (RPM) 轉換為相對離心力 (RCF) 或 g 力,請使用 G 力計算器.
。Network error: Failed to fetch
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?為便利客戶閱讀,此頁面中文以機器翻譯完成。雖然我們已盡力確保機器翻譯的準確性,但機器翻譯並非完美。如果您對機器翻譯的內容不滿意,請參考英文版本。