ABN454
Anticorps anti-tau (T22) oligomère
serum, from rabbit
Synonyme(s) :
Microtubule-associated protein tau oligomer, Tau oligomer, PHF-tau oligomer, Paired helical filament-tau oligomer, Neurofibrillary tangle protein oligomer
About This Item
Produits recommandés
Source biologique
rabbit
Niveau de qualité
Forme d'anticorps
serum
Type de produit anticorps
primary antibodies
Clone
polyclonal
Espèces réactives
human
Technique(s)
ELISA: suitable
dot blot: suitable
immunofluorescence: suitable
immunohistochemistry: suitable
immunoprecipitation (IP): suitable
neutralization: suitable
western blot: suitable
Numéro d'accès NCBI
Numéro d'accès UniProt
Conditions d'expédition
wet ice
Modification post-traductionnelle de la cible
unmodified
Informations sur le gène
human ... MAPT(4137)
Description générale
Spécificité
Immunogène
Application
Neurosciences
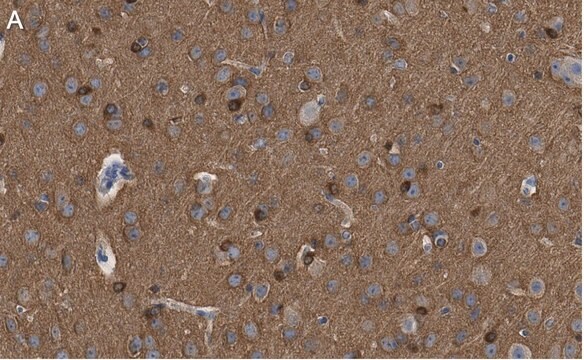
Immunohistochemistry Analysis: A 1:245-1,000 dilution from a representative lot detected tau oligomers in frontal cortices from Alzheimer′s Diseased (AD) and Lewy Body Diseased (LBD) patients (Courtesy of Prof. Rakez Kayed, University of Texas, Galveston).
Immunofluorescence Analysis: A representative lot detected oligomeric tau in chronic traumatic encephalopathy (CTE) brain tissue sections, while little or no tau oligomer immunoreactivity was seen in non-CTE human brain sections. The tau oligomer immunoreactivity colocalized with that of tau pThr231 with a cis conformation, but not tau pThr231 with a trans conformation, between pThr231 and Pro232 (Kondo, A., et al. (2015). Nature. 523(7561):431-436).
Immunofluorescence Analysis: A representative lot detected oligomeric tau immunoreactivity in paraffin-embedded frontal cortex sections from Alzheimer′s diseased (AD) brains (Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946-1959).
Western Blotting Analysis: A 1:1,000 dilution from a representative lot detected oligomeric tau in chronic traumatic encephalopathy (CTE) in Tau Aggregate lysate.
Western Blotting Analysis: Representative lots detected oligomeric tau, but not monomeric tau, or any other oligomeric and fibrillar proteins (Wu J.W., et al. (2013). J. Biol. Chem. 288(3):1856-1870; Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946-1959).
Dot Blot Analysis: A representative lot detected tau oligomers, but not tau monomer or paired helical filaments (PHFs) (Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946-1959).
ELISA Analysis: Representative lots detected vitro formed tau oligomers as well as tau oligomers in PBS-soluble brain extracts from progressive supranuclear palsy (PSP) patients (Lasagna-Reeves, C.A., et al. (2012). Sci. Rep. 2:700; Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946-1959).
ELISA Analysis: A representative lot showed selective reactivity toward oligomeric tau, while exhibiting greatly reduced immunoreactivity toward tau fibrils, and no reactivity toward monomeric tau, or other protein oligomers or fibrils (e.g., Aβ, α-synuclein, or islet amyloid polypeptide) (Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946-1959).
Immunoprecipitation Analysis: Representative lots immunoprecipitated oligomeric tau from Alzheimer′s Diseased (AD), but not non-AD brains (Lasagna-Reeves, C.A., et al. (2012). Sci. Rep. 2:700; Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946-1959).
Neutralizing Analysis: Representative lots neutralized oligomeric tau toxicity to SH-SY5Y human neuroblastoma cells (Lasagna-Reeves, C.A., et al. (2012). Sci. Rep. 2:700; Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946-1959).
Immunohistochemistry Analysis: A representative lot detected oligomeric tau immunoreactivity in paraffin-embedded brain sections from progressive supranuclear palsy (PSP) patients (Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946-1959).
Maladies neurodégénératives
Qualité
Analyse par western blotting : Une dilution au 1/1000e de cet anticorps a permis de détecter des oligomères de protéine tau dans du lysat de tissu cérébral atteint de la maladie d'Alzheimer (AD), mais pas dans du lysat de tissu cérébral sans AD.
Description de la cible
Forme physique
Stockage et stabilité
Recommandations d'utilisation : Dès réception, et avant retrait du bouchon, centrifuger le flacon et mélanger délicatement la solution. Diviser en aliquotes dans des microtubes à centrifuger et les stocker à -20 °C. Éviter les congélations/décongélations répétées, qui peuvent détériorer les IgG et nuire aux performances du produit.
Clause de non-responsabilité
Vous ne trouvez pas le bon produit ?
Essayez notre Outil de sélection de produits.
Code de la classe de stockage
10 - Combustible liquids
Classe de danger pour l'eau (WGK)
WGK 1
Certificats d'analyse (COA)
Recherchez un Certificats d'analyse (COA) en saisissant le numéro de lot du produit. Les numéros de lot figurent sur l'étiquette du produit après les mots "Lot" ou "Batch".
Déjà en possession de ce produit ?
Retrouvez la documentation relative aux produits que vous avez récemment achetés dans la Bibliothèque de documents.
Notre équipe de scientifiques dispose d'une expérience dans tous les secteurs de la recherche, notamment en sciences de la vie, science des matériaux, synthèse chimique, chromatographie, analyse et dans de nombreux autres domaines..
Contacter notre Service technique


![3-[1,3-Dihydro-4-(5-hydroxy-1-pentyn-1-yl)-1-oxo-2H-isoindol-2-yl]-2,6-piperidinedione ≥95.0%](/deepweb/assets/sigmaaldrich/product/structures/165/184/ebc29f1b-f63f-4e48-afb5-b3aa4c69795a/640/ebc29f1b-f63f-4e48-afb5-b3aa4c69795a.png)