L2884
Leupeptine
powder, ≥90% (HPLC)
Synonyme(s) :
Leupeptine hemisulfate salt, Acétyle-Leu-Leu-Arg-al, N-acétyle-L-leucyle-L-leucyle-L-argininal hemisulfate salt
About This Item
Produits recommandés
product name
Leupeptine, microbial, ≥90% (HPLC)
Source biologique
microbial
Niveau de qualité
Pureté
≥90% (HPLC)
Forme
powder
Solubilité
H2O: 10 mM (Solutions are stable for a week at 4 °C. Stock solutions are stable up to 6 months at −20 °C.)
H2O: 50 mg/mL
Température de stockage
−20°C
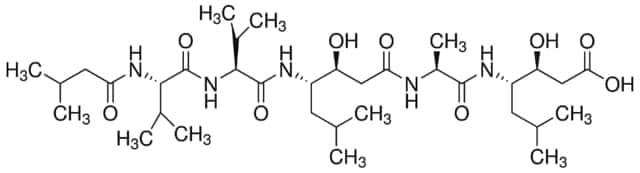
Chaîne SMILES
OS(O)(=O)=O.CC(C)C[C@H](NC(C)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C=O.CC(C)C[C@H](NC(C)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C=O
InChI
1S/2C20H38N6O4.H2O4S/c2*1-12(2)9-16(24-14(5)28)19(30)26-17(10-13(3)4)18(29)25-15(11-27)7-6-8-23-20(21)22;1-5(2,3)4/h2*11-13,15-17H,6-10H2,1-5H3,(H,24,28)(H,25,29)(H,26,30)(H4,21,22,23);(H2,1,2,3,4)/t2*15-,16-,17-;/m00./s1
Clé InChI
CIPMKIHUGVGQTG-VFFZMTJFSA-N
Vous recherchez des produits similaires ? Visite Guide de comparaison des produits
Description générale
- au niveau du site actif des protéases à sérine, la leupeptine forme un adduit hémiacétal covalent entre le groupement aldéhyde de la leupeptine et le groupement hydroxyle d'un résidu sérine du site actif de l'enzyme ;
- au niveau du site actif des protéases à cystéine, l'atome de carbone électrophile (aldéhyde) de la leupeptine forme une liaison similaire avec l'atome de soufre d'un résidu cystéine du site actif de l'enzyme.
Actions biochimiques/physiologiques
Remarque sur l'analyse
Code de la classe de stockage
11 - Combustible Solids
Classe de danger pour l'eau (WGK)
WGK 3
Point d'éclair (°F)
Not applicable
Point d'éclair (°C)
Not applicable
Équipement de protection individuelle
Eyeshields, Gloves, type N95 (US)
Certificats d'analyse (COA)
Recherchez un Certificats d'analyse (COA) en saisissant le numéro de lot du produit. Les numéros de lot figurent sur l'étiquette du produit après les mots "Lot" ou "Batch".
Déjà en possession de ce produit ?
Retrouvez la documentation relative aux produits que vous avez récemment achetés dans la Bibliothèque de documents.
Les clients ont également consulté
Articles
ReadyShield® phosphatase and protease inhibitor cocktail FAQ for sample protection in a variety of cell types and tissue extracts, including mammalian, plant, and microbial samples. Our ReadyShield® Protease Inhibitor Cocktail is a non-freezing solution that contains inhibitors with a broad specificity for serine, cysteine, acid proteases and aminopeptidases.
ReadyShield® phosphatase and protease inhibitor cocktail FAQ for sample protection in a variety of cell types and tissue extracts, including mammalian, plant, and microbial samples. Our ReadyShield® Protease Inhibitor Cocktail is a non-freezing solution that contains inhibitors with a broad specificity for serine, cysteine, acid proteases and aminopeptidases.
ReadyShield® phosphatase and protease inhibitor cocktail FAQ for sample protection in a variety of cell types and tissue extracts, including mammalian, plant, and microbial samples. Our ReadyShield® Protease Inhibitor Cocktail is a non-freezing solution that contains inhibitors with a broad specificity for serine, cysteine, acid proteases and aminopeptidases.
ReadyShield® phosphatase and protease inhibitor cocktail FAQ for sample protection in a variety of cell types and tissue extracts, including mammalian, plant, and microbial samples. Our ReadyShield® Protease Inhibitor Cocktail is a non-freezing solution that contains inhibitors with a broad specificity for serine, cysteine, acid proteases and aminopeptidases.
Notre équipe de scientifiques dispose d'une expérience dans tous les secteurs de la recherche, notamment en sciences de la vie, science des matériaux, synthèse chimique, chromatographie, analyse et dans de nombreux autres domaines..
Contacter notre Service technique