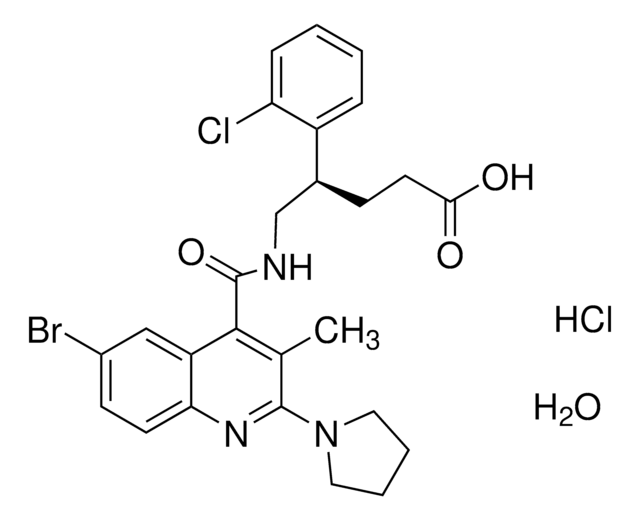
L2254
Lipoprotein-Lipase aus Kuhmilch
ammonium sulfate suspension, ≥2,000 units/mg protein (BCA)
Synonym(e):
LPL, Phospholipase A1, Diacylglycerin Lipase, Diacylglycerin-Acylhydrolase
About This Item
Empfohlene Produkte
Biologische Quelle
bovine milk
Qualitätsniveau
Form
ammonium sulfate suspension
Spezifische Aktivität
≥2,000 units/mg protein (BCA)
Lagertemp.
2-8°C
Allgemeine Beschreibung
Lipoprotein-Lipase (LPL) aus Rindermilch ist ein Glykoprotein. Sie liegt als Homodimer vor und besteht aus zwei N-verknüpften Oligosacchariden. Sie ist hitzelabil.Lipoprotein-Lipase ist ein Enzym, das auf der Oberfläche vaskulärer Endothelzellen zu finden und an Kapillarwänden verankert ist. Sie liegt hauptsächlich in Fettgewebe, Herz- und Muskelgewebe vor. Sie wird von extrahepatischem Gewebe, insbesondere von Adipozyten, synthetisiert, und das kodierende Gen des Proteins ist auf dem Chromosom 8p22 lokalisiert.
Anwendung
- als Zusatzstoff zur Untersuchung ihrer Wirkung auf die Aufnahme von DiI-(1,1′-Dioctadecyl-3,3,3′-tetramethyl-indocarbocyaninperchlorat)-VLDL (Very Low Density Lipoprotein) in den Brustkrebszellen MDA-MB-231
- zur Behandlung mikrovaskulärer Endothelzellen (HBMEC) im menschlichen Gehirn für die Lipolyse von triglyzeridreichen Lipoproteinen (TGRL)
- zur Untersuchung ihrer Wirkung auf die Genexpression in normalen Astrozyten beim Menschen
- bei der primären Hepatozytenisolierung und Lipoproteinbindung, um die Sulf2-Hemmung bei T2DM-Mäusen zur Verbesserung der diabetischen Dyslipidämie zu identifizieren
- im TGF-β1-Assay (Transforming Growth Factor-Beta Immunoassay) zur Prüfung, ob das TGF-β-Signalsystem die Hochregulierung und Aktivierung des aktivierenden Transkriptionsfaktors 3 (ATF3) in humanen aortalen Endothelzellen (HAEC) reguliert, die durch Lipolyse-Produkte induziert werden
- zur Isolierung humaner TGRL
- für In-vitro-Lipolyse-Assays mit HSPG-gebundenem LPL zur Untersuchung der Wirkung von humanem ApoE2 (Lys146→Glen) auf den Lipoproteinstoffwechsel
- zur Hydrolyse von Triglyceriden
- für die Entwicklung eines In-vitro-Modells der gastrointestinalen Verdauung zur Untersuchung der Wirkung von Chlorophyll auf die Lipidverdauung
Biochem./physiol. Wirkung
Einheitendefinition
Physikalische Form
Angaben zur Herstellung
Lagerklassenschlüssel
11 - Combustible Solids
WGK
WGK 3
Flammpunkt (°F)
Not applicable
Flammpunkt (°C)
Not applicable
Persönliche Schutzausrüstung
Eyeshields, Gloves, type N95 (US)
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
Artikel
Lipid Induced Insulin Resistance
Instructions for working with enzymes supplied as ammonium sulfate suspensions
Protokolle
Lipoprotein lipase (LPL) hydrolyzes triglycerides associated with VLDL.
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.