MAB1562
Anticorpo anti-proteina prionica a.a. 109-112, clone 3F4
clone 3F4, Chemicon®, from mouse
Sinonimo/i:
PrP, CD230
About This Item
Prodotti consigliati
Origine biologica
mouse
Livello qualitativo
Forma dell’anticorpo
purified immunoglobulin
Tipo di anticorpo
primary antibodies
Clone
3F4, monoclonal
Reattività contro le specie
hamster, human
Produttore/marchio commerciale
Chemicon®
tecniche
ELISA: suitable
immunohistochemistry (formalin-fixed, paraffin-embedded sections): suitable
immunoprecipitation (IP): suitable
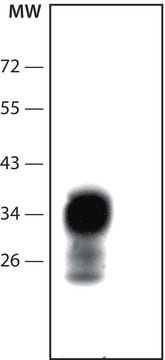
western blot: suitable
Isotipo
IgG2a
N° accesso NCBI
N° accesso UniProt
Condizioni di spedizione
dry ice
modifica post-traduzionali bersaglio
unmodified
Informazioni sul gene
human ... PRNP(5621)
Descrizione generale
Specificità
Immunogeno
Applicazioni
immagini rappresentative ottenute con un precedente lotto. Colorazione ottimale con tampone citrato, pH 6.0. Recupero dell′epitopo: cervello umano
Immunostochimica (Kitamoto et al., 1987):
1:100-1:1,000 *Vedere il protocollo qui sotto.
Nei tessuti fissati l'epitopo deve essere ri-esposto mediante pretrattamento con una delle seguenti procedure:
a. acido formico per 10 minuti a temperatura ambiente (Kitamoto et al., 1987)
b. idrolisi mediante autoclave (Kitamoto et al., 1991)
microonde (BioGenex, San Ramon, CA)
Western blot: (Kascsak, R.J., 1991; Kascsak, R.J., 1987):
è stata utilizzata una diluizione 1:10,000-1:100,000 di un lotto precedente.
Immunoprecipitazione: (Kascsak, R.J., 1991; Kascsak, R.J., 1987):
è stata utilizzata una diluizione 1:10-1:100 di un precedente lotto.
ELISA: (Kascsak, R.J., 1991; Kascsak, R.J., 1987):
È stata usata una diluizione 1:100,000 di un precedente lotto.
Sarà cura dell′utente finale stabilire le diluizioni di lavoro ottimali.
Qualità
morfologia/pattern di colorazione della proteina prionica (N. Cat. MAB1562) in cervello normale. Il tessuto è stato pretrattato con citrato, pH 6.0. Questo lotto di anticorpo è stato diluito a 1:500, utilizzando rilevazione IHC-Select con HRP-DAB. L'immunoreattività si presenta prevalentemente come colorazione del corpo cellulare dei neuroni.
La colorazione ottimale si ottiene con tampone citrato, pH 6,0. Recupero dell'epitopo: cervello umano
Descrizione del bersaglio
Stato fisico
Note legali
Not finding the right product?
Try our Motore di ricerca dei prodotti.
Raccomandato
Codice della classe di stoccaggio
12 - Non Combustible Liquids
Classe di pericolosità dell'acqua (WGK)
WGK 2
Punto d’infiammabilità (°F)
Not applicable
Punto d’infiammabilità (°C)
Not applicable
Certificati d'analisi (COA)
Cerca il Certificati d'analisi (COA) digitando il numero di lotto/batch corrispondente. I numeri di lotto o di batch sono stampati sull'etichetta dei prodotti dopo la parola ‘Lotto’ o ‘Batch’.
Possiedi già questo prodotto?
I documenti relativi ai prodotti acquistati recentemente sono disponibili nell’Archivio dei documenti.
Il team dei nostri ricercatori vanta grande esperienza in tutte le aree della ricerca quali Life Science, scienza dei materiali, sintesi chimica, cromatografia, discipline analitiche, ecc..
Contatta l'Assistenza Tecnica.