Reinstwasser für BPA-freie Kulturmedien
Merina Corpinot, PhD1, Maurizio Zuccotti, PhD2, Daniel Darbouret, PhD1
1R&D Department, Lab Water Solutions, Merck, Guyancourt, France, 2Laboratory of Developmental Biology, Department of Biology and Biotechnology “Lazzaro Spallanzani”, University of Pavia, Italy
Ziel dieser Studie war es, ein Verfahren zum Nachweis niedriger Konzentrationen des endokrinen Disruptors Bisphenol A (BPA) in Wasser zu etablieren und insbesondere zu dokumentieren, wie sich mithilfe eines mit BioPak® Ultrafilter ausgestatteten Milli- Q® IQ 7000-Wasseraufbereitungssystems (empfohlene Konfiguration für molekularbiologische Anwendungen) Referenz-Reinstwasser herstellen lässt, das für die BPA-sensitive Embryonenforschung geeignet ist.
Erfahren Sie mehr über:
- Gesundheitliche Bedenken bezüglich endokriner Disruptoren wie Bisphenol A
- Fallstudie 1: HP-SPME-GC-MS zur Messung von BPA in Reinstwasser zur Verwendung in der Embryonenforschung
- Fallstudie 2: BPA-freies Reinstwasser für zytologische und molekulare Analysen zur Beurteilung des Einflusses von BPA auf die Eizellreifung
- Fallstudie 3: BPA-freies Reinstwasser für Medien, die in Zellbildgebungssystemen zum Einsatz kommen
- Schlussfolgerung: Reinstwasser für BPA-sensitive Untersuchungen in der Embryogenese-Forschung
- Materialien und Methoden der HP-SPME-GC-MS-Analyse von BPA
- Zugehörige Produkte
Gesundheitliche Bedenken bezüglich endokriner Disruptoren wie Bisphenol A
Endokrine Disruptoren sind Chemikalien, die das endokrine System von Mensch und Tier stören. Sie beeinflussen das Wachstum sowie die Fortpflanzung, das Immunsystem und das Nervensystem und verursachen gesundheitsschädliche Folgen. Endokrine Disruptoren sind in Kunststoffen (einschließlich Verbrauchsmaterialien und Ausrüstung im Labor), Lacken, Harzen und Tensiden enthalten und gelten als allgegenwärtig.
Normen und Standards regeln die Höchstdosen endokriner Disruptoren, die in Lebensmitteln und Getränken zulässig sind, sowie deren Vorhandensein in der Umwelt. Unter den verschiedenen industriell hergestellten endokrinen Disruptoren ist BPA einer der am weitesten verbreiteten. BPA ist als „Xenoestrogen“ bekannt, da es eine östrogenartige Wirkung hat und daher große gesundheitliche Bedenken aufwirft. Mehrere Studien haben bestätigt, dass BPA die Produktion von Hormonen und die Expression ihrer Gene beeinträchtigt. Neuere Forschungsergebnisse zeigen, dass selbst niedrige BPA-Konzentrationen (20 µg/kg/Tag, was eine umweltrelevante BPA-Dosis während einer einwöchigen Exposition des Fetus darstellt) die Produktion gesunder Oozyten beeinflussen können (Abbildung 1), da das BPA ihr Wachstum im Eierstock stört.1-3
Das Ziel der unten beschriebenen Studien war es, nachzuweisen, dass mit einem Milli-Q®-Aufbereitungssystem hergestelltes Reinstwasser (Typ 1) eine geeignete Qualität aufweist, um in der Herstellung von garantiert BPA-freien Medien und Lösungen eingesetzt zu werden, insbesondere zur Produktion von BPA-freien Kulturumgebungen für reproduktionsbiologische Experimente.
- Studie 1 zeigt die Ergebnisse der BPA-Analyse in verschiedenen Wasserarten mittels Hochleistungs-Festphasen-Mikroextraktion in Verbindung mit Gaschromatographie mit Massenspektrometrie-Kopplung (HP-SPME-GC-MS).
- Studie 2 präsentiert die Ergebnisse zytologischer und molekularer Analysen zur Bewertung des Einflusses von BPA auf die Eizellreifung.
- Studie 3 zeigt die Bedeutung von Wasser für Nährmedien, die in Zellbildgebungssystemen zum Einsatz kommen.
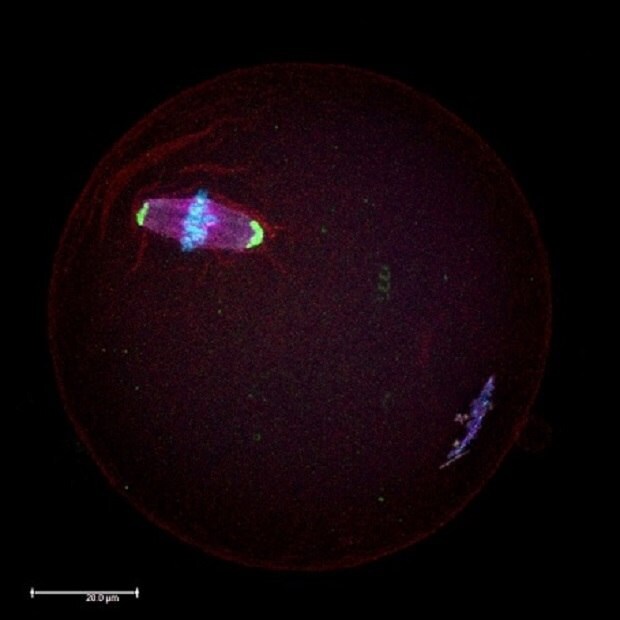
Abbildung 1.Mikroskopische immunzytochemische Analyse einer Maus-Oozyte in der Metaphase II (MII) der Meiose mittels Antikörper gegen Proteine in den meiotischen Spindeln (rot) und Zentrosomen (grün). Die Chromosomen sind mit DAPI (blau) gegengefärbt.
Fallstudie 1: HP-SPME-GC-MS zur Messung von BPA in Reinstwasser zur Verwendung in der Embryonenforschung
In der Reproduktionsbiologie ist Wasser ein Schlüsselreagenz für Analysen (z. B. Zubereitung von Nährmedien).
Wissenschaftler an der italienischen Universität Pavia analysierten mit einer reproduzierbaren HP-SPME-GC-MS-Methode den BPA-Gehalt von Reinstwasser, das in ihrer Embryonenforschung verwendet wird. Das analysierte Reinstwasser stammte aus einem Milli-Q® IQ 7000-Reinstwasseraufbereitungssystem, in welches Elix®-Reinwasser eingespeist wurde. Dieses Reinwasser wurde in einem ähnlichen System wie dem Milli-Q® HX-Wassersystem hergestellt, das eine Kombination von Reinigungstechnologien, einschließlich fortschrittlicher Umkehrosmose (RO), Elix®-Elektroentionisierung (EDI) und eine bakteriziden UV-Lampe, umfasste. Das Milli-Q® IQ 7000-Reinstwassersystem wurde am Einsatzort mit einem BioPak®-Endfilter ausgestattet (Abbildung 2). Der BioPak®-Endfilter wird für molekularbiologische Anwendungen empfohlen, um Wasser herzustellen, das frei von Endotoxinen, Nukleasen, Proteasen und Bakterien ist.

Abbildung 2.Darstellung des Versuchsaufbaus zur Analyse von Bisphenol A (BPA) in verschiedenen Laborwasserarten mittels HP-SPME-GC-MS
Die HP-SPME-GC-MS-Analyse zeigte, dass BPA innerhalb einer Nachweisgrenze (NWG) von 4 nM weder im Elix®-Reinwasser noch im Milli-Q®-Reinstwasser nachgewiesen werden konnte (Tabelle 1).
Wie bereits erwähnt, wurde Versuchswasser verwendet, das einen BioPak®-Endfilter durchlaufen hatte. Abbildung 3 zeigt ein typisches Ergebnis der Analyse von drei Wasserproben, die nacheinander aus einem Milli-Q® IQ 7000-System mit BioPak®-Endfilter am Einsatzort abgegeben wurden. Die Wiederholbarkeit und Zuverlässigkeit der GC-MS-Analyse sowie die täglichen Schwankungen der BPA-Konzentration wurden gemäß den im Abschnitt „Materialien und Methoden“ unten beschriebenen Verfahren bewertet.
Die Ergebnisse zeigen, dass das Reinstwasser aus dem Milli-Q® IQ 7000-System von hoher Qualität war und kein nachweisbares BPA (NWG = 4 nM) enthielt. Insbesondere ergab die Analyse, dass BPA nicht aus dem System in das Produktwasser auslaugte, da es in dem Leitungswasser, mit dem das Wasseraufbereitungssystem gespeist wurde, nicht nachweisbar war.
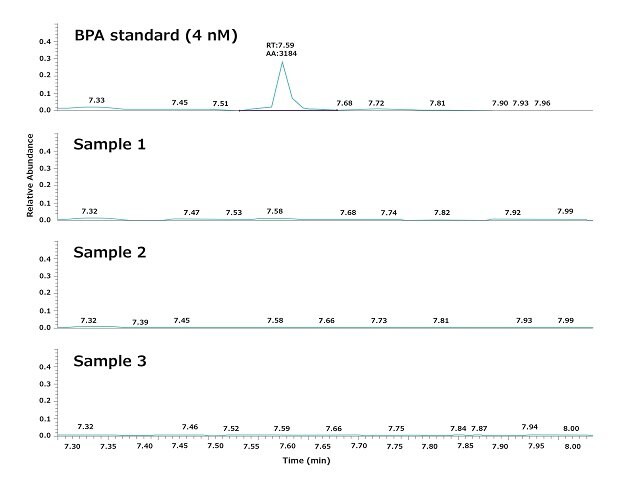
Abbildung 3.Chromatogramme, die den BPA-Gehalt in drei Reinstwasserproben zeigen. Die Proben wurden nacheinander am Einsatzort aus einem Milli-Q® IQ 7000-Reinstwassersystem mit BioPak®-Endfilter entnommen.
Die folgenden beiden Studien zeigen, dass in Milli-Q®-Reinstwasseraufbereitungssystemen hochwertiges Wasser ohne BPA-Kontamination hergestellt werden kann, das zur Untersuchung der Auswirkungen endokriner Disruptoren auf die Entwicklung von Gameten und Embryonen verwendet wird. Besonders geeignet ist Wasser, das nach dem BioPak®-Endfilter entnommen wird.
Fallstudie 2: BPA-freies Reinstwasser für zytologische und molekulare Analysen zur Beurteilung des Einflusses von BPA auf die Eizellreifung
Bei der Messung der Wirkung eines bestimmten Moleküls muss die Versuchsumgebung frei von dem zu untersuchenden Molekül sein. In der vorgestellten Studie verwendeten Wissenschaftler qRT-PCR, um die Transkriptexpression von vier Genen mit maternalen Effekten zu analysieren: Brg1 (Chromatin-Remodellierer), Dnmt3a und Dnmt3l (DNA-Methylasen) und Oct-4 (Marker für pluripotente Zellen). Die Proben bestanden aus drei unabhängigen Pools von 10 Metaphase-II-(MII-)Maus-Oozyten. Die vollständig ausgewachsenen antralen Oozyten wurden nach 15 Stunden In-vitro-Maturation (IVM) in Gegenwart von 10 nM, 100 nM oder 1000 nM BPA gewonnen.
Die Ergebnisse zeigten, dass BPA die meiotische Reifungsteilungen bei den drei getesteten Dosen nicht stoppte, da die überwiegende Mehrheit (96,5 %) der Oozyten das MII-Stadium erreichte, ohne dass ein signifikanter Unterschied zwischen den Kontrollproben (CTR) und den exponierten Proben bestand. Die Expression aller untersuchen Gene war jedoch bei allen getesteten BPA-Konzentrationen signifikant verändert (entweder höher oder niedriger im Vergleich zur unbehandelten Kontrolle), mit Ausnahme von Oct-4, das bei 10 nM BPA unverändert blieb (Abbildung 4).
Diese Experimente zur Genexpression wurden mit Reinstwasser durchgeführt, das einem Milli-Q® IQ 7000-Wasseraufbereitungssystem mit BioPak®-Endfilter entnommen wurde. Die Ergebnisse bestätigen, dass Reinstwasser aus diesem Milli-Q®-System für den Einsatz in BPA-sensitiven Anwendungen in der Reproduktionsbiologie geeignet ist.
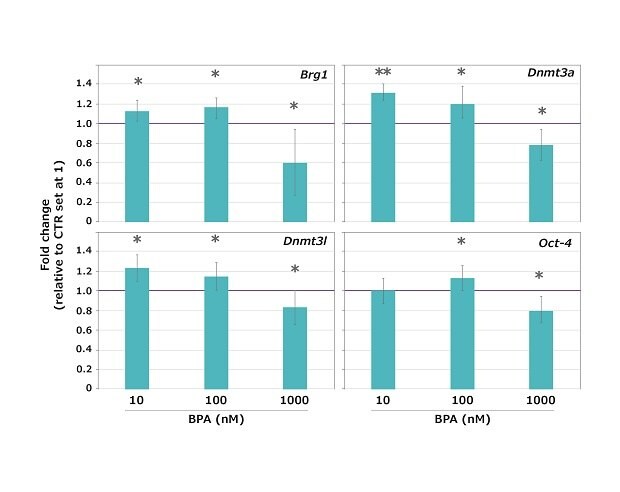
Abbildung 4.Expressionsprofile der Gene Brg1, Dnmt3a, Dnmt3l und Oct-4 mit maternalem Effekt in Maus-Oozyten, die während des GV-MII-Übergangs 10, 100 oder 1000 nM BPA ausgesetzt waren. Die Expressionswerte von Kontrollproben (CTR) wurden für die Berechnung der n-fachen Veränderung auf 1 festgelegt. Die Werte werden als Mittelwert ± SD angegeben. * p < 0,05 ** p < 0,001.
Fallstudie 3: BPA-freies Reinstwasser für Medien, die in Zellbildgebungssystemen zum Einsatz kommen
Die Zeitrafferbildgebung ermöglicht es, die Bewegungen innerhalb einer Oozyte während ihres Übergangs vom GV-Stadium (germinal vesicle, Keimvesikel) zum MII-Entwicklungsstadium zu beobachten (Video4). Diese Bewegungen, die als zytoplasmatische Beweglichkeit bezeichnet werden, dienen als nicht-invasiver zytologischer Marker zur Beurteilung der Entwicklungskompetenz einer weiblichen Gamete (Qualität und Fähigkeit einer Gamete, sich weiterzuentwickeln).5,6 In der vorliegenden Studie wurde mithilfe dieses neuartigen Verfahrens die zytoplasmatische Beweglichkeit von Oozyten während des GV-MII-Übergangs untersucht, die in Abwesenheit oder Vorhandensein steigender BPA-Konzentrationen herangereift waren (Abbildung 5 zeigt repräsentative Daten nur für 100 nM BPA).
Eine Analyse der Zellen mittels Particle Image Velocimetry (PIV) zeigte spezifische Entwicklungszeitfenster, in denen Oozyten empfindlich auf die getesteten BPA-Dosen reagieren. Bemerkenswerterweise waren die Veränderungen der zytoplasmatischen Beweglichkeit bei Exposition gegenüber der niedrigen BPA-Konzentration von 10 nM über einzelne Zeitpunkte verteilt, während sie bei höheren Dosen auf längeren Zeitrafferaufnahmen während des GV-MI-Übergangs sichtbar waren. So führte 100 nM BPA zu signifikanten Unterschieden innerhalb des Zeitintervalls, in dem das Chromatin kondensiert und sich die Centromere zu großen Chromozentren aneinander lagern, um die Äquatorialebene auszubilden (Abbildung 5).
Die Nährmedien, die an den oben genannten Experimenten zur Untersuchung der zytoplasmatischen Beweglichkeit beteiligt waren, wurden mit Reinstwasser aus einem Milli-Q® IQ 7000-Wasseraufbereitungssystem mit BioPak®-Endfilter hergestellt. Die Ergebnisse unterstreichen die Notwendigkeit von BPA-freien Nährmedien, da bereits niedrige Dosen von 100 nM BPA Auswirkungen haben können, die durch die Analyse der Genexpression oder der zytoplasmatischen Beweglichkeit nachgewiesen werden können.
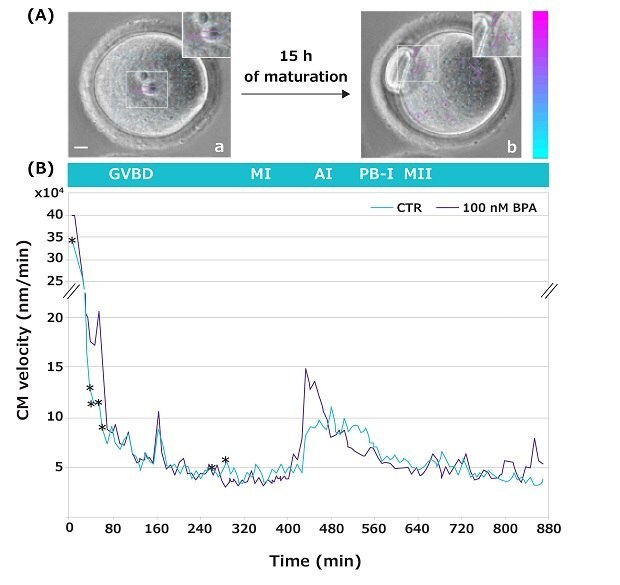
Abbildung 5.(A) Repräsentative Aufnahme einer GV-Oozyte in Bild 1 (a) und einer MII-Oozyte in Bild 100 (b). Die kleineren Ausschnitte zeigen vergrößerte Bilder mit Pfeilen (Geschwindigkeitsvektoren), die die Intensität und Richtung der zytoplasmatischen Bewegungen anzeigen. Farbe und Länge der Pfeile zeigen das Geschwindigkeitsmodul der Bewegungen im Vergleich zum vorherigen Bild an. Farbbalken der Vektorskala (nm/min): Blau entspricht einer niedrigen Geschwindigkeit, violett einer hohen Geschwindigkeit. Balken: 10 μm. (B) Zytoplasmatisches Bewegungsprofil während des GV-MII-Übergangs von Maus-Oozyten bei Abwesenheit (grün) oder Vorhandensein (grau) von 100 nM BPA. * p < 0,05.
Schlussfolgerung: Reinstwasser für BPA-sensitive Untersuchungen in der Embryogenese-Forschung
Die zunehmende Empfindlichkeit und Leistung von Forschungsverfahren erfordert hochwertiges gereinigtes Wasser, um Kontaminationen zu verhindern, die die Genauigkeit und Authentizität von Versuchsergebnissen beeinträchtigen können. Insbesondere in Studien mit hochsensitiven Untersuchungsinstrumenten benötigen Wissenschaftler hochreines Wasser, um Störsubstanzen (z. B. BPA, Endotoxine, Nukleasen, Proteasen und Bakterien) zu vermeiden, die die Ergebnisse verfälschen können, und um die Zuverlässigkeit ihrer experimentellen Analysen zu erhöhen.
Im Bereich der Embryologie hat sich gezeigt, dass selbst niedrige Konzentrationen des endokrinen Disruptors BPA die Embryogenese-Forschung beeinträchtigen, indem sie das Wachstum der Oozyten stören. Dies ist bedenklich, da das Leitungswasser eines Labors zwar BPA-frei sein kann, BPA jedoch aus Verbrauchsmaterialien und Laborgeräten ausgelaugt werden und die Versuchsergebnisse verfälschen kann.
Obwohl wir in diesem Artikel zeigen, dass niedrige BPA-Werte die meiotische Reifung nicht hemmen, beeinflusst bereits eine sehr niedrige BPA-Konzentration von nur 10 nM sowohl die Genexpression als auch die Bewegungen innerhalb der Oozyte während ihres Übergangs vom GV-Stadium (Keimvesikel) zum MII-Entwicklungsstadium. Diese Ergebnisse verdeutlichen die Notwendigkeit, embryologische Versuche in einer BPA-freien Umgebung mit Reinstwasser durchzuführen, in dem garantiert kein BPA nachweisbar ist.
Reinstwasser aus dem Milli-Q® IQ 7000-Reinstwasseraufbereitungssystem mit BioPak®-Endfilter enthielt erwiesenermaßen kein nachweisbares BPA, selbst wenn eine sehr niedrige Nachweisgrenze von nur 4 nM gemäß der in diesem Artikel beschriebenen Methode verwendet wurde. Das in diesem System hergestellte Reinstwasser kann somit sicher verwendet werden, um die Auswirkungen endokriner Disruptoren auf die Entwicklung von Gameten und Embryonen zu untersuchen.
Um Wasseraufbereitungslösungen zu finden, die auf die Erfordernisse on BPA-sensitiven Analysen ausgerichtet sind, fordern Sie Unterstützung von unseren Experten für Laborwasser an.
Materialien und Methoden der HP-SPME-GC-MS-Analyse von BPA
Geräte
- Zur Durchführung der Wasseranalyse wurde das Single-Quadrupol-GC/MS-System Thermo Scientific DSQII (TraceDSQII Massenspektrometer, TraceGCUltra Gaschromatograph) mit dem CombiPAL Autosampler (CTC Analytics, Schweiz) verwendet.
- Bei der Säule handelte es sich um eine 30 mm lange Restek Rxi™ Kapillarsäule (5 ms) mit 0,25 mm Innendurchmesser und 0,25 µm Filmdicke (5 % Diphenyl/95 % Dimethylpolysilan – Restek Corporation, Bellefonte, USA) mit Helium als Trägergas bei einer konstanten Flussrate von 1,0 ml/min.
- Es wurde eine SPME-Faservorrichtung aus 100-µm-Polydimethylsiloxan (PDMS) verwendet. Die Fasern wurden vor jeder Analyse 20 Minuten lang in der Nadelheizung bei 250 °C gereinigt, um Verschleppungen aus der vorherigen Analyse zu vermeiden.
Standardpräparation
Es wurde eine BPA-Stammlösung mit einer Konzentration von 10 nM in 100%igem Ethanol hergestellt. Es wurde eine Reihe von Verdünnungen durchgeführt, um eine Kalibrierkurve mit vier verschiedenen Konzentrationsstufen zu erhalten: 1, 2, 4, 40 nmol/l unter Verwendung von HPLC-Wasser.
Experiment 1: Beurteilung der Wiederholbarkeit und Zuverlässigkeit der GC-MS-Analyse
Drei Wasserproben (5 ml) wurden nacheinander aus jeder der drei Quellen entnommen: Leitungswasser, Elix®-Reinwasser sowie ein Milli-Q® IQ 7000-Reinstwassersystem mit BioPak®-Endfilter am Einsatzort. Vor der Probenahme wurden 5 l Wasser zum Spülen des Systems entnommen.
Experiment 2: Beurteilung der täglichen Schwankungen der BPA-Konzentration
Alle 24 Stunden über drei Tage wurden drei Wasserproben (5 ml) entnommen: Leitungswasser, Elix®-Reinwasser sowie aus einem Milli-Q® IQ 7000-Reinstwassersystems mit BioPak®-Endfilter am Einsatzort. Vor der Probenahme wurden 5 l Wasser entnommen. Chromatogramme sind auf Anfrage erhältlich.
Wasserproben
5 ml Wasser (Leitungswasser, Elix®-Reinstwasser und mit BioPak®-gefiltertes Reinstwasser) wurden zur Analyse in 20-ml-Glasfläschchen gegeben. In jedes Fläschchen wurden 200 mg KHCO3, 1 g NaCl und ein Einweg-Magnetrührstab hinzugefügt.
Derivatisierung
30 µl Essigsäureanhydrid wurden der Wasserprobe zugegeben und die Fläschchen wurden mit einer Headspace-Aluminiumkappe mit einem Polytetrafluorethylen-beschichteten Septum versiegelt. Es wurde eine vollständige Reaktion erreicht. Die Reaktionszeit bis zur Derivatisierung betrug 5 min bei 80 °C (unter kontinuierlichem Rühren bei 50 U/min). Die Headspace-Extraktion von BPA wurde mit der 100-µm-PDMS-Faser bei 80 °C für 30 Minuten unter Rühren (500 U/min) durchgeführt. Die SPME-Faser wurde im Injektor 2 Minuten lang bei 250 °C desorbiert.
Chromatographische Analyse
Die Ofentemperatur wurde 2 Minuten lang auf 150 °C gehalten, dann um 30 °C/min auf 280 °C erhöht und 6 Minuten lang gehalten. Die Injektion erfolgte im Splitless-Modus, und die Splitless-Zeit betrug 2 Minuten, wobei die Temperatur des PTV-Injektors auf 250 °C gehalten wurde. Die Transferleitung wurde auf 290 °C und die Ionenquelle auf 250 °C gehalten. Das MS-Modul wurde im Elektronenstoßionisationsmodus (EI) betrieben, und die Ionen wurden sowohl im Full-Scan-Modus mit einem Massenbereich von m/z 35–350 amu als auch im SIM-Modus (selektive Überwachung) erfasst, wobei m/z 270 als Quantifizierungsion für BPA verwendet wurde.
Danksagung
Die Autoren danken dem Labor für Entwicklungsbiologie der Universität Pavia (Italien) für die Durchführung der vorliegenden Forschung und unseren F&E-Kollegen für ihren Beitrag zu diesem Projekt.
Literatur
Um weiterzulesen, melden Sie sich bitte an oder erstellen ein Konto.
Sie haben kein Konto?