AAV-Prozessintensivierung unter Einsatz von Lyse mit hoher Salzkonzentration und salztoleranter Endonuklease

- Was bei der Zelllyse zu berücksichtigen ist
- Was beim DNA-Abbau zu berücksichtigen ist
- Entwicklung einer salztoleranten Endonuklease zur AAV-Vektor-Produktion
- Auswahl der richtigen Benzonase® für Ihre Anwendung
- Lösung der Herausforderungen einer hohen Salzkonzentration
- Benzonase® – Häufig gestellte Fragen
- Deviron® – Häufig gestellte Fragen
Die Herstellung von Vektoren auf Basis von Adeno-assoziierten Viren (AAV) umfasst einen Zwischenschritt, der Zelllyse und Nuklease-Behandlung kombiniert. Dabei werden Detergenzien verwendet, um die Lipid-Doppelschicht der Zellen aufzubrechen und die Vektoren freizusetzen, während die DNA der Wirtszelle und die verbleibenden Plasmide durch eine Endonuklease verdaut werden. Damit sollen die Patientensicherheit sichergestellt und die Effizienz der Downstream-Prozesse verbessert werden. Gemäß der „Guidance for Gene Therapy Investigational New Drug Applications“ (Anleitung für den Antrag zur Prüfung eines neuen Medikaments für die Gentherapie) der FDA aus dem Jahr 2020 müssen der Gehalt der verbleibenden DNA weniger als 10 ng/Dosis und die Fragmentgröße weniger als etwa 200 Basenpaare betragen.
Diese Seite beschreibt, welche zentralen Aspekte bei der Zelllyse zu berücksichtigen sind und wie die Kombination einer hohen Salzkonzentration mit einer salztoleranten Endonuklease zur Steigerung des Vektortiters und der Infektiosität eingesetzt werden kann.
Was bei der Zelllyse zu berücksichtigen ist
Obwohl der Zelllyseschritt unkompliziert erscheint, ist er mit einigen Herausforderungen verbunden. Die gewöhnlich zur Zelllyse verwendeten Detergenzien, wie TRITON™ X-100 (4-tert-Octylphenolpolyethoxylat), können problematisch sein. Aufgrund seines Eintrags in der Liste der REACH-Verordnung (Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe) wurde die ungenehmigte Verwendung von TRITON™ X-100 in der Europäischen Union durch die Europäische Kommission ab Januar 2021 untersagt. Dieser Eintrag zusammen mit den strengen Richtlinien hinsichtlich seiner Verwendung in der EU beruhen auf den endokrinen und mutagenen Wirkungen der Abbauprodukte von TRITON™ X-100, die als gefährlich für Patienten und Umwelt befunden wurden.
Weitere Überlegungen bei der Auswahl eines Detergens zur Zelllyse sind, dass es die viralen Vektoren und die Infektiosität der viralen Partikel nicht beeinträchtigen und die nachgeschalteten Prozesse nicht stören sollte. Dies kann bei der Verwendung von Polysorbaten der Fall sein. Die ausgewählten Detergenzien müssen sich außerdem problemlos entfernen und in nachfolgenden Arbeitsschritten nachweisen lassen.
Abschließend ist es wichtig, den Einfluss der Salzkonzentration auf die Zelllyse und die Vektorausbeute zu verstehen. Traditionell enthielten Lysepuffer, die zur Freisetzung von AAV-Capsiden verwendet wurden, eine physiologische Salzkonzentration (150 mM NaCl). In aktuellen Publikationen wird jedoch berichtet, dass eine Erhöhung der Salzkonzentration auf 500 mM die Anzahl der Vektorpartikel und die infektiösen Titer erhöht und die AAV-Aggregation verringert. Wie nachfolgend beschrieben, kann eine hohe Salzkonzentration die Aktivität herkömmlicher Endonukleasen, die während der AAV-Vektor-Herstellung für den DNA-Abbau eingesetzt werden, allerdings negativ beeinflussen.
Effekt eines hohen Salzgehalts während der Zwischenschritte auf die AAV-Ausbeute
Es wurde eine Studie durchgeführt, um den Einfluss einer hohen Salzkonzentration während der Zelllyse zu bestimmen. AAV5-Vektoren wurden in HEK293-Zellen produziert, die entweder mit TRITON™ X-100, Polysorbat 20, Deviron® C16 oder Deviron® 13-S9 lysiert wurden. Die Ausgangszahl (Baseline) der in einem Prozess produzierten Capside wurde unter Verwendung von 150 mM NaCl in einem Lysepuffer mit Polysorbat 20 bestimmt. Die Verwendung von 500 mM Salz im Lysepuffer führte zu einer Steigerung der AAV5-Capsid-Titer um durchschnittlich 29 % (Abbildung 1).

Abbildung 1.Einfluss der Lyse bei hoher Salzkonzentration auf die Produktion der AAV5-Titer
Effekt einer hohen Salzkonzentration während der Zwischenschritte auf die AAV-Infektiosität
Zur Messung des Effekts einer NaCl-Konzentration von 500 mM auf die AAV-Infektiosität wurde eine vergleichbare Studie durchgeführt, bei der AAV2-Vektoren in HEK293-Zellen hergestellt wurden. Als Baseline wurde ein Lysepuffer mit 150 mM NaCl und Polysorbat 20 verwendet. Bei Erhöhung der Salzkonzentration auf 500 mM und Verwendung verschiedener Detergenzien wurde eine mindestens 10-fache Erhöhung der Infektiosität beobachtet (Abbildung 2). Wie oben erwähnt, ist ein zusätzlicher Vorteil der Verwendung einer hohen Salzkonzentration während der Lyse die Verringerung der AAV-Aggregation.
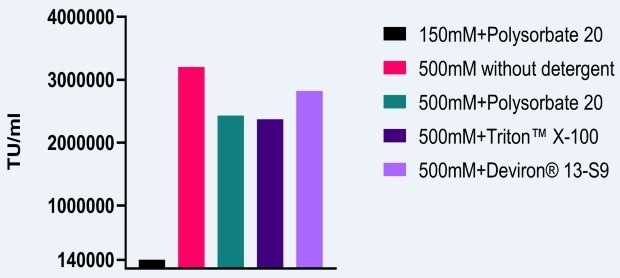
Abbildung 2.Einfluss einer hohen Salzkonzentration auf die AAV5-Infektiosität.
Was beim DNA-Abbau zu berücksichtigen ist
Wie der Zelllyseschritt ist auch der DNA-Abbau mit mehreren Herausforderungen verbunden. Eine der größten von ihnen ist die notwendige Qualität der Materialien, um regulatorischen Anforderungen gerecht zu werden und die Robustheit der Lieferkette sicherzustellen. Neben der Einhaltung der GMP-Vorgaben müssen u. a. die Reinheit, der Glykosylierungsstatus und der Keimgehalt berücksichtigt werden. Auch die Toleranz des Enzyms gegenüber einem hohen Salzgehalt war ein entscheidender Faktor, der den Einsatz hoher Salzkonzentrationen während der AAV-Herstellung verhinderte.
Wichtige Kriterien für die Enzymauswahl zur AAV-Herstellung
- IPEC PQG GMP oder Gleichwertiges verfügbar, FDA DMF/BBMF
- > 99 % reines Produkt
- Frei von posttranslationalen Modifikationen
- Mykoplasmentest
- Test auf Adventiv-Viren
- Endotoxintest
- Verfügbarkeit begleitend zur Lieferung bereitgestellter repräsentativer Produktproben („Tailgate Samples“)
- Starke Robustheit von Logistik und Versorgung
- Technische Unterstützung bei anwendungsbezogenen Fragestellungen
- Präzises Nachweisverfahren
Außerdem muss das für den DNA-Abbau eingesetzte Enzym in der nachgeschalteten Verarbeitung effektiv entfernt werden, und seine Aktivität bei der im Prozess verwendeten Salzkonzentration ist zu berücksichtigen. Während eine höhere Salzkonzentration die Vektorausbeute verbessern kann, findet bei einer hohen Ionenstärke keine Interaktion zwischen herkömmlichen Endonukleasen und der DNA statt, wodurch die Spaltung der Nukleinsäure verhindert wird. Traditionell bedeutete dies, dass ein angemessenes Gleichgewicht zwischen der gewünschten Nukleaseaktivität und der Salzkonzentration hergestellt werden musste.
Entwicklung einer salztoleranten Endonuklease zur AAV-Vektor-Produktion
Um den Bedarf an einer Endonuklease mit effektiver Aktivität bei den für die Zelllyse bevorzugten hohen Salzkonzentrationen anzugehen, haben wir mittels fortschrittlichem Protein-Engineering die Benzonase® Salt Tolerant Endonuclease entwickelt. Diese Endonuklease nichttierischen Ursprungs kann DNA und RNA bei Salzkonzentrationen von bis zu 1000 mM abbauen und wird als IPEC-, PQG-, GMP-konformes sowie als Emprove®-Expert-Produkt auf den Markt gebracht.
Zur Produktion der Benzonase® Salt Tolerant Endonuclease wird ein bakterielles Expressionssystem eingesetzt, da dies eine exakt definierte Molekülgröße ohne posttranslationale Modifikationen sicherstellt und für eine hohe Chargenreproduzierbarkeit sorgt. Die folgenden Daten zeigen die Aktivität und die Vorteile der Benzonase® Salt Tolerant Endonuclease.
Proteinprofil
Zur Produktion der Benzonase® Salt Tolerant Endonuclease wird ein bakterielles Expressionssystem eingesetzt, da dies eine exakt definierte Molekülgröße ohne posttranslationale Modifikationen sicherstellt und für eine hohe Chargenreproduzierbarkeit sorgt. Im Gegensatz zu in Hefe exprimierten Enzymen, die stark glykosyliert sind und deren Profil eine hohe posttranslationale Variabilität zwischen den einzelnen Chargen aufweist, ermöglicht das homogene Profil des Proteins den genauen Nachweis mittels Immunassays (z. B. ELISA).

Abbildung 3.Identität und Reinheit von Benzonase® Salt Tolerant Endonuclease und Wettbewerberprodukt A, gezeigt anhand reduzierender SDS-PAGE.

Abbildung 4.Identität und Reinheit von Benzonase® Salt Tolerant Endonuclease und Wettbewerberprodukt A, gezeigt anhand nicht-reduzierender SDS-PAGE.
Die Produktion von Benzonase® Salt Tolerant Endonuclease Emprove® Expert in E. coli zeigt folgende Eigenschaften:
- Sauberes und reines Protein
- Frei von posttranslationalen Modifikationen
- Hohe Chargenreproduzierbarkeit
Das Fazit in den Abbildungen 3 und 4 zeigt, dass die Benzonase® Salt Tolerant Endonuclease Emprove® Expert eine exakt definierte Molekülgröße aufweist. Die bei hohen Salzkonzentrationen aktive Referenz-Endonuklease (Wettbewerberprodukt A) dagegen nicht.
Endonuklease-Aktivität
Endonukleasen sind für ihre Aktivität auf Magnesium angewiesen. Abbildung 5 zeigt einen Vergleich der Aktivität von Benzonase® Salt Tolerant Endonuclease mit einer nicht-salztoleranten Nuklease bei verschiedenen Magnesium-Konzentrationen. Die Aktivität der Benzonase® Salt Tolerant Endonuclease wurde durch hohe Salzkonzentrationen gesteigert und war in einem Bereich von 1–10 mM Mg2+ und 500 mM Salz stabil. Bei einer Salzkonzentration von 150 mM und 500 mM war die Aktivität von Benzonase® Salt Tolerant Endonuclease in Gegenwart von 10 mM Mg2+ vergleichbar mit der Standardnuklease (Abbildung 6).
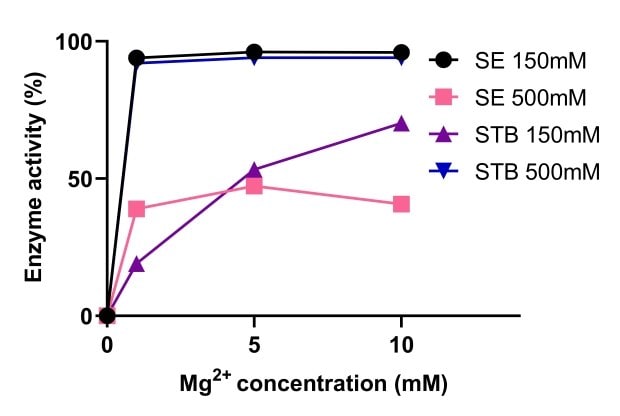
Abbildung 5.Vergleich der Aktivität von Benzonase® Salt Tolerant Endonuclease mit einer nicht-salztoleranten Endonuklease
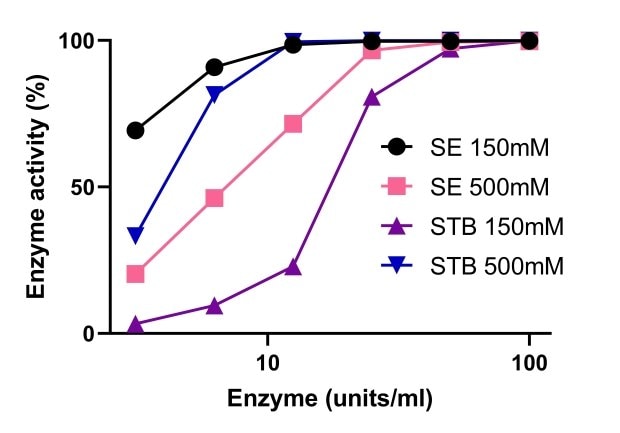
Abbildung 6.Vergleich der Aktivität von Benzonase® Salt Tolerant Endonuclease mit einer nicht-salztoleranten Endonuklease
Abbildung 7 zeigt die Ergebnisse einer Studie, bei der DNA mit Benzonase® Salt Tolerant Endonuclease und anderen kommerziell erhältlichen salzaktiven oder nicht-salzaktiven Endonukleasen bei 500 mM und 1 M NaCl für eine Stunde bei 37 °C verdaut wurde. Benzonase® Salt Tolerant Endonuclease erzielte einen vollständigen Abbau der DNA bei 500 mM und 1 M Salz und zeigte im Vergleich zu den anderen Endonukleasen eine vergleichbare oder bessere Leistung.

Abbildung 7.Vergleich des DNA-Abbaus mit Benzonase® Salt Tolerant Endonuclease und einer kommerziell erhältlichen salzaktiven sowie einer nicht-salzaktiven Endonuklease für eine Stunde bei 37 °C.
Legende
M – GeneRuler Ultra Low Range DNA Ladder Kat.-Nr. SM1213
Comp A ** – Salzaktive Endonuklease, Wettbewerberprodukt
SE – Standard-Endonuklease, z. B. Kat.-Nr.103773
STB – Benzonase® Salt Tolerant Endonuclease Emprove® Expert
Größe der Nukleinsäurefragmente
Benzonase® Salt Tolerant Endonuclease verdaut DNA auf ein nicht mehr nachweisbares Niveau unter einer Größe von 10 Basenpaaren. Abbildung 8 zeigt die DNA-Fragmente nach Auftrennung auf einem 4%igen Agarosegel mit einem Marker für DNA mit niedrigem Molekulargewicht. Bei 150 mM Salz war die DNA nicht vollständig verdaut; bei 500 mM Salz verblieben nach dem Abbau keine DNA-Fragmente.

Abbildung 8.Größenauftrennung der DNA-Fragmente nach Abbau mit 25 U/ml Benzonase® Salt Tolerant Endonuclease für 30 Minuten bei 37 °C.
Kompatibilität von Benzonase® Salt Tolerant Endonuclease mit Detergenzien bei der Produktion von AAV-Vektoren
Die Aktivität von Benzonase® Salt Tolerant Endonuclease wurde hinsichtlich der gemeinsamen Verwendung mit vier verschiedenen, zur Zelllyse verwendeten Detergenzien evaluiert: TRITON™ X-100, Polysorbat 20 und zwei alternative Detergenzien, die als Reaktion auf das Verbot von TRITON™ X-100 entwickelt wurden – Deviron® C16 und 13-S9. Wie in Abbildung 9 gezeigt, wurde die Aktivität von Benzonase® Salt Tolerant Endonuclease von keinem der Detergenzien beeinträchtigt. Die DNA wurde im Lysepuffer mit 500 mM NaCl in Gegenwart von TRITON™ X-100, Polysorbat 20 und Deviron® 13-S9 (7B) vollständig abgebaut.
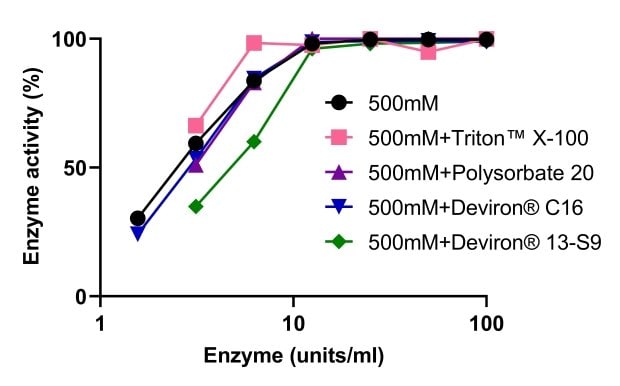
Abbildung 9.Aktivität der Benzonase® Salt Tolerant Endonuclease bei Verwendung in Kombination mit verschiedenen Detergenzien.

Abbildung 10.DNA-Abbau mit Benzonase® Salt Tolerant in Kombination mit verschiedenen Detergenzien.
Auswahl der richtigen Benzonase® für Ihre Anwendung
Benzonase® Salt Tolerant Endonuclease sollte für Anwendungen verwendet werden, bei denen die Salzkonzentration mindestens 200 mM beträgt. Bei einer Salzkonzentration von 500 mM wird die DNA vollständig verdaut und, wie oben gezeigt, ist es möglich, eine 29%ige Steigerung des AAV-Titers und eine nahezu 2.000%ige Steigerung der Infektiosität zu erzielen. Durch die Verwendung hoher Salzbedingungen bei diesem Zwischenschritt wird die Patientensicherheit erhöht, da die AAV-Aggregation gehemmt und die effektive Entfernung der DNA von den Virus-Capsiden sichergestellt wird. Das posttranslationale Profil der Benzonase® Salt Tolerant Endonuclease gewährleistet außerdem die Verwendung eines nicht glykosylierten und leicht nachzuweisenden Proteins bei der Arzneimittelproduktion.
Für Anwendungen mit einer Salzkonzentration unter 200 mM sollte die Standard-Endonuklease Benzonase® Safety Plus verwendet werden.
Tabelle 3 fasst die Spezifikationen unserer drei GMP-konformen Benzonase®-Endonuklease-Referenzen zusammen. Benzonase® Salt Tolerant Endonuclease ist Teil des Emprove®-Programms, das Hersteller dabei unterstützt, beim Übergang von der Entwicklung zur Herstellung Störungen zu minimieren und gründliche Risikobewertungen durchzuführen. Das Programm bietet Roh- und Ausgangsstoffe, die strengen Qualitätskontrollen gemäß führenden Branchenstandards unterliegen. Die Materialien, die Teil dieses Programms sind, werden durch umfangreiche Dokumentationspakete gestützt, die den Informationsbedarf pharmazeutischer Hersteller hinsichtlich der Qualifizierung von Rohstoffen, der Durchführung von Risikobewertungen und der Optimierung des Herstellungsprozesses erfüllen.
Lösung der Herausforderungen einer hohen Salzkonzentration
Die Verwendung einer hohen Salzkonzentration während des Zelllyseschritts bei der AAV-Produktion liefert hohe Titer und eine verbesserte Infektiosität. Traditionell war dieser Ansatz jedoch untauglich, da hohe Salzbedingungen die Aktivität herkömmlicher Endonukleasen, die zum DNA-Abbau eingesetzt werden, hemmen.
Die Verfügbarkeit der Benzonase® Salt Tolerant Endonuclease ermöglicht die Verwendung von Salzkonzentrationen in einer Größenordnung von 500 mM während des Zwischenschritts von Zelllyse und DNA-Abbau und ist kompatibel mit allen getesteten Detergenzien, einschließlich der Deviron®-Detergenzien, die als Alternative zu TRITON™ X-100 dienen können.
Zum Anfordern eines Probenmusters der Benzonase® Salt Tolerant Endonuclease oder eines Produkts des Deviron® Portfolios klicken Sie bitte auf den Link unten und füllen Sie unser sehr kurzes Webformular aus.
Benzonase® – Häufig gestellte Fragen
Definition
Was ist Benzonase® Endonuklease?
Benzonase® Endonuklease ist ein Markenname und Eigentum von Merck für Endonukleasen in Forschungs- und Bioprozess-Anwendungen.
Welche Enzyme fallen unter diesen Markennamen?
Die Familie der Benzonase® Endonukleasen umfasst derzeit zwei verschiedene Enzyme.
- Die Produktlinie der älteren Benzonase® Endonukleasen, wie die Benzonase® Endonuclease Safety Plus, die aus Serratia marcescens isoliert wurde und im E. coli K12-Stamm W3110 rekombinant produziert wird. Das Protein hat ein Molekulargewicht von 30 kDa und einen isoelektrischen Punkt (pI) von 6,85.
- Die neue Benzonase® Salt Tolerant Endonuclease (1.4445). Sie wurde mit hochmodernen Protein-Engineering Fertigkeiten entwickelt, um die höchste Aktivität bei hohen Salzkonzentrationen sicherzustellen.
Das Protein ist ein Monomer mit einem Molekulargewicht von ca. 27 kDa und einem pI bei pH 9,68. Ein Abschnitt dieser häufig gestellten Fragen ist speziell diesem Enzym gewidmet.
Wirkungsweise
Bei welcher Art von Nukleinsäuren wird Benzonase® Nuklease eingesetzt? Kann ich es bei der Isolierung von RNA verwenden?
Benzonase® Nuklease ist eine vielseitige Endonuklease, die alle Formen von DNA und RNA (einzelsträngig, doppelsträngig, linear und zirkulär) angreift und abbaut.
Was ist das Endergebnis eines vollständigen Nukleinsäureabbaus durch Benzonase® Nuklease?
Benzonase® Nuklease verdaut Nukleinsäuren vollständig zu 5'-Monophosphat-terminierten Oligonukleotiden mit einer Länge von 2‒5 Basen.
Hemmung und Entfernung
Wie kann Benzonase® Nuklease inaktiviert werden? Wie kann sie entfernt werden?
Mit EDTA als Chelatbildner für essentielle Metallionen kann eine reversible Hemmung erreicht werden. Eine irreversible Inaktivierung kann nur unter extremen Bedingungen erreicht werden (100 mM NaOH bei 70 °C über 30 Minuten). Benzonase kann durch Chromatographie vom Zielprodukt getrennt werden. Aufgrund der robusten Natur dieser Endonuklease empfehlen wir jedoch, Benzonase nicht zu verwenden, wenn ein nukleasefreies Endprodukt benötigt wird.
Warum funktioniert die Benzonase® Endonuklease nicht? Wodurch wird die Aktivität gehemmt?
Benzonase® Endonuklease ist unter einem breiten Spektrum von Betriebsbedingungen aktiv (siehe den Abschnitt zu Enzymeigenschaften); allerdings ist eine Konzentration von 1–2 mM Mg2+ für die Aktivität der Benzonase® Endonuklease essentiell.
Mn2+ kann Mg2+ ersetzen; seine optimale Aktivität erreicht das Enzym jedoch nur in Gegenwart von Mg2+. Es wird durch einwertige Kationenkonzentrationen > 300 mM, Phosphatkonzentrationen > 100 mM und Ammoniumsulfatkonzentrationen > 100 mM gehemmt (ca. 50 % Aktivität). Außerdem hemmen Konzentrationen von > 1 mM EDTA die Aktivität von Benzonase® Endonuklease.
Ich beobachte einen Verlust der Aktivität: warum?
Benzonase® Endonuklease ist in der Regel sehr stabil, aber in seltenen Fällen kann ein Verlust der Aktivität beobachtet werden. Dafür gibt es mehrere mögliche Ursachen: Eine irreversible Inaktivierung kann auf die Gegenwart von denaturierenden Substanzen, z. B. Proteasen, in der Probe zurückzuführen sein. Auch falsche Lagerung kann die Ursache sein. Eine reversible Inaktivierung beruht häufig auf der Gegenwart von chelierenden Substanzen wie EDTA, die die essentiellen Magnesiumionen entfernen.
Wie entferne ich Benzonase® Endonuklease in einem Bioprozess-Template?
Die Entfernung von Benzonase® Endonuklease kann durch mehrere nachgeschaltete Betriebseinheiten erreicht werden, u. a. Tiefenfiltration zur Klärung, Tangentialflussfiltration (TFF) zur Konzentration und Diafiltration sowie Chromatografie (IEX, SEC, HIC). Weitere Informationen finden Sie im Anhang, Kapitel 2 „Entfernung von Benzonase® Endonuklease“ (Seite 36).
STABILITÄT UND BETRIEBSBEDINGUNGEN
Meine Benzonase® Endonuklease wurde auf dem Labortisch liegen gelassen. Ist sie noch verwendbar?
Wir haben Benzonase® Endonuklease umfangreichen Stabilitätstests unterzogen und sind zu dem Schluss gekommen, dass sie äußerst stabil ist. Selbst bei längeren Inkubationszeiten bei 37 °C behielt Benzonase® Endonuklease über mehrere Monate hinweg eine Aktivität von > 90 %.
Ich möchte einen anderen Puffer verwenden. Welche Bedingungen sind für die vollständige Aktivität von Benzonase® Endonuklease unbedingt erforderlich? Wodurch wird die Aktivität verringert?
Für die Aktivität von Benzonase® Endonuklease sind 1‒2 mM Mg2+ erforderlich. Benzonase wird durch einwertige Kationenkonzentrationen > 50 %, Phosphatkonzentrationen > 20 mM und Ammoniumsulfatkonzentrationen > 25 mM gehemmt (ca. 50 % Aktivität).
Wie viel zusätzliche Benzonase® Endonuklease muss ich zugeben, wenn ich bei niedrigen Temperaturen arbeite?
Für die Aktivität von Benzonase® Endonuklease sind 1‒2 mM Mg2+ erforderlich. Benzonase wird durch einwertige Kationenkonzentrationen > 50 %, Phosphatkonzentrationen > 20 mM und Ammoniumsulfatkonzentrationen > 25 mM gehemmt (ca. 50 % Aktivität).
ANWENDUNGEN ZUR PROTEINEXTRAKTION
Ist Benzonase® Endonuklease mit Proteaseinhibitor-Cocktails kompatibel?
Ja. Es ist jedoch Vorsicht geboten, da viele Proteaseinhibitor-Cocktails EDTA enthalten. Konzentrationen von mehr als 1 mM EDTA hemmen die Aktivität von Benzonase® Endonuklease.
Mein Protein ist nicht löslich und ich muss die Aufreinigung unter denaturierenden Bedingungen durchführen. Wird Benzonase® Endonuklease auch in Harnstoff noch funktionieren?
Die Aktivität von Benzonase® Endonuklease nimmt in Gegenwart von Harnstoff in Konzentrationen bis zu 6 M tatsächlich zu. Bei Harnstoff 6 M steigt die Enzymaktivität zunächst an und nimmt dann mit der Zeit ab. Bei Harnstoff 7 M denaturiert die Benzonase® Endonuklease nach 15 Minuten und die Aktivität geht verloren. Vor der Inaktivierung kommt es jedoch zu einem erheblichen Abbau der Nukleinsäuren. Höhere Ausgangskonzentrationen der Benzonase® Endonuklease können die Auswirkungen von Harnstoff 7 M teilweise ausgleichen.
Warum gibt es so viele Varianten von Benzonase® Endonuklease? Was bedeutet HC? Welche Auswirkungen hat eine Reinheit von 90 % gegenüber 99 %?
Um ein möglichst breites Spektrum von Verarbeitungs- und Kostenanforderungen zu erfüllen, ist Benzonase® Endonuklease in zwei verschiedenen Reinheitsgraden erhältlich: Reinheitsgrad I (> 99 % rein) und Reinheitsgrad II (> 90 % rein). Beide Qualitäten sind in einer Konzentration von 25 U/μl oder in einer hohen Konzentration (HC) von 250 U/μl erhältlich. Bezüglich Bulk-Ware wenden Sie sich bitte an den Anpassungsservice (Custom Services).
Eine vollständige Liste der Benzonase® Produkte und ihre Unterschiede finden Sie auf unserer Endonuklease-Seite hier.
Was ist das Endergebnis eines vollständigen Nukleinsäureabbaus durch Benzonase® Endonuklease?
Benzonase® Endonuklease verdaut Nukleinsäuren vollständig zu 5'-Monophosphat-terminierten Oligonukleotiden mit einer Länge von 2‒5 Basen.
ANWENDUNGEN IN DER BIOPHARMAZEUTISCHEN PRODUKTION
Welche Qualität/Quantität von Benzonase® Endonuklease ist für eine bestimmte Anwendung angemessen?
Es gibt mehrere Parameter, die die Aktivität von Benzonase® Endonuklease beeinflussen. Daher unterscheiden sich die optimalen Bedingungen von Prozess zu Prozess und müssen experimentell bestimmt werden. Zur Verringerung der Viskosität ist Benzonase® Endonuklease, Reinheitsgrad II (≥ 90 %) häufig ausreichend. Unter standardmäßigen Assay-Bedingungen entspricht eine Einheit Benzonase® Endonuklease ungefähr der Enzymmenge, die erforderlich ist, um 37 µg DNA innerhalb von 30 Minuten zu verdauen.
Bei welchem Schritt muss ich Benzonase® Endonuklease in meinen Prozess einführen?
Die Antwort auf diese Frage variiert und hängt davon ab, warum Sie Benzonase® Endonuklease verwenden. Die aufgeführten Beispielanwendungen werden Ihnen hoffentlich bei der Beantwortung dieser Frage helfen. Im Regelfall wird Benzonase® Endonuklease am besten nach der Kultivierung und vor der Virusgewinnung zugegeben.
Ist Benzonase® Endonuklease sicher?
Ja, es wurden toxikologische Studien mit Benzonase® Endonuklease durchgeführt (interne Berichte verfügbar). Die systemische Toxizität nach einmaliger Anwendung wurde an Mäusen und Ratten untersucht: selbst bei sehr hohen Dosen wurden keine toxischen Effekte beobachtet. Außerdem wurde bei Mäusen, die intravenös mit einer sehr hohen Dosis Benzonase® Endonuklease behandelt wurden, kein mutagenes Potential beobachtet.
Warum ist der Bereich des Füllvolumens in den Röhrchen mit 5 Millionen Einheiten nicht angegeben?
Da die Aktivität (U/ml) von Benzonase® Endonuklease zwischen Produktionschargen variieren kann, haben wir uns entschieden, nicht das Volumen, sondern die Einheiten pro Röhrchen anzugeben. Das Volumen pro Röhrchen kann aus den Informationen zur Aktivität im Analysenzertifikat (CoA) problemlos berechnet werden.
BENZONASE® SALT TOLERANT ENDONUCLEASE
Ist die Sequenz vergleichbar mit den älteren Benzonase® Produkten wie der Benzonase® Safety Plus?
Die Benzonase® Salt Tolerant Endonuclease ist ein brandneues Enzym, das mit hochmodernem Protein Engineering entwickelt wurde, um die höchste Aktivität bei einer hohen Salzkonzentration zu gewährleisten. Sie hat eine andere Aminosäuresequenz als andere, ältere Benzonase® Produkte.
Was sind die Unterschiede hinsichtlich der Betriebsbedingungen gegenüber älteren Benzonase® Produkten?
Als Endonuklease funktioniert die Benzonase® Salt Tolerant Endonuclease unter denselben Bedingungen wie ältere Benzonase® Produkte. Die einzige Ausnahme ist die Konzentration einwertiger Kationen, für die wir mindestens 300 mM NaCl empfehlen.
Wie hemme ich dieses Enzym?
Das Enzym kann durch Zugabe von EDTA oder Hitzeeinwirkung gehemmt werden.
Wie entferne ich dieses Enzym?
Informationen hierzu finden Sie oben im Abschnitt „Wie entferne ich Benzonase® Endonuklease in einem Bioprozess-Template?“.
Wie kann ich Spuren dieses Enzyms nachweisen?
Für unser älteres Benzonase® Enzym vervollständigt ein spezielles ELISA-Kit unser Angebot, um einen robusten Nachweis der Benzonase® Salt Tolerant Endonuclease sicherzustellen.
Warum sollte ich dieses Enzym anstelle anderer Standard-Nukleasen verwenden?
Alle auf dem Markt existierenden Standard-Nukleasen für das Bioprocessing basieren auf einer sehr ähnlichen Aminosäuresequenz. Dementsprechend ist ihre Fähigkeit, Nukleinsäuren bei hohen Salzkonzentrationen zu verdauen, vergleichbar und gilt als nicht optimal.
Ihre effektiven Betriebsbedingungen für die Konzentration einwertiger Kationen reicht von 0 bis 200 mM. Dies ist vergleichbar mit den physiologischen Salzkonzentrationen in biologischen Prozessen.
Gleichzeitig hat sich gezeigt, dass die Verwendung höherer Salzkonzentrationen, über der physiologischen Konzentration, während der Zelllyse von HEK-Zellen einen spürbaren Einfluss auf die Gesamtprozessausbeute hat. Bei einer NaCl-Konzentration von 500 mM sind die Infektiosität und die AAV-Rückgewinnungsrate signifikant höher als bei einer Salzkonzentration von 150 mM.
Die Verwendung salztoleranter Nukleasen ist daher notwendig, um Nukleinsäuren bei diesen Hochsalzbedingungen zu entfernen.
Kann ich trotzdem normale Nukleasen bei Salzkonzentrationen > 200 mM verwenden?
Die Aktivität normaler Nukleasen oberhalb der physiologischen Salzkonzentration ist drastisch verringert. Daher müssen mehr Enzyme zugefügt werden, wodurch wiederum die Aufreinigung der Arzneimittel komplizierter wird. Dies führt auch zu einer schlechten Kosteneffizienz des Verfahrens und höheren Betriebskosten. Daher empfehlen wir die Verwendung einer salztoleranten Nuklease.
Kann ich Nachweiskits anderer Anbieter zum Nachweis der Benzonase® Salt Tolerant Endonuclease verwenden? Beispielsweise andere Kits, die auf andere „salzaktive“ Nukleasen spezialisiert sind?
Die Benzonase® Salt Tolerant Endonuclease ist ein brandneues Enzym; außer unseren eigenen Nachweiskits kann kein anderes Nachweiskit auf dem Markt dieses Enzym nachweisen.
Hinweis: Jedes Produkt, das nicht über einen offiziellen Merck Kanal vertrieben wird und bei dem der Markenname „Benzonase®“ verwendet wird, ist als Produktfälschung zu betrachten.
Warum ist der Expressionswirt so wichtig für die Enzymproduktion?
Die Proteinexpression kann mit mehreren Produktionsplattformen erzielt werden. Am häufigsten ist die Expression auf Basis von Hefen und Bakterien. Allerdings sind die resultierenden Produkte nicht gleich, und die Profile der posttranslationalen Modifikationen unterscheiden sich je nach verwendeter Plattform.
In Hefe exprimierte Proteine sind stark glykosyliert und modifiziert. Dies kann zu verschiedenen Problemen bei der Verwendung des Produkts führen, u. a. eine schlechte Nachweisgenauigkeit in Antikörper-Assays.
Die wichtigste salzaktive Endonuklease auf dem Markt wird in Hefe exprimiert.
Warum kann die posttranslationale Modifikation von Nukleasen deren Nachweisgenauigkeit und Effizienz beeinflussen?
Glykosylierte Proteine zeigen ein inhomogenes Profil (wie in Abbildung 2 gezeigt), das zwischen einzelnen Chargen nicht reproduzierbar ist. Da die Standard-Nachweismethoden Immunassays verwenden, können die Antikörper, die zum Nachweis des zu untersuchenden Proteins erzeugt wurden, das volle Spektrum der Modifikationen, die mit einer Hefeexpression beobachtet werden, nicht abdecken. Dies führt zu einer schlechten Nachweisgenauigkeit von Antikörper-basierten Nachweismethoden wie ELISA-Kits.
Wie sieht das Toxikologieprofil dieses Enzyms aus?
Die Benzonase® Salt Tolerant Endonuclease hat dasselbe Toxikologieprofil wie andere Mitglieder des Benzonase® Portfolios.
Können Sie mich dabei unterstützen, die kostengünstigste Nuklease für mein Verfahren zu bestimmen? Unter Berücksichtigung der Effizienz und Ausbeute des Gesamtprozesses.
Wir führen ein Komplettsortiment an Nukleasen, welche die regulatorischen Anforderungen sowie die Anforderungen an Ihre Prozessbedingungen erfüllen. Zögern Sie nicht, unseren MSAT-Support (Manufacturing Science And Technology) für Ihre Prozessentwicklung anzufordern. Unsere Experten decken die gesamten Herstellungs-Templates ab, von den Upstream-Prozessen bis zur Endabfüllung.
Deviron® – Häufig gestellte Fragen
Kann ich TRITON™ X-100 weiterhin verwenden, wenn ich nicht in der Europäischen Union ansässig bin?
Das Verbot von TRITON™ X-100 wurde von der ECHA1 im Rahmen der REACH2-Verordnung beschlossen. Der maßgebliche Faktor war die hohe Toxizität dieses Produkts für die menschliche Gesundheit und die Umwelt. Daher befasst sich die Branche intensiv mit den Möglichkeiten zum Ersatz dieses Produkts in der biopharmazeutischen Produktion. Regulierungsbehörden außerhalb der EU werden die Verwendung des Produkts ebenfalls bewerten, sodass es in der Zukunft zu weiteren Verboten kommen wird.
Warum kann ich keine Detergenzien in Forschungsqualität in der biopharmazeutischen Produktion einsetzen?
Detergenzien werden in der Regel in riesigen Volumen mit organisch-chemischen Kettenreaktionen hergestellt. Dabei sind die Rohstoffe oft von minderer Qualität, um die Produktionskosten zu senken. Dies führt zu sehr gefährlichen Verunreinigungen in den Endprodukten, wie Dioxin oder Nitrosamin. Diese Detergenzien in Forschungsqualität werden nur für Reinigungsanwendungen verwendet und sollten nicht in der Nähe von Arzneimittelformulierungen angetroffen werden.
Was sind die wesentlichen Schritte zur Umstellung auf Deviron®?
Das Deviron® Portfolio umfasst 3 Chargen des gemäß GMP EXCiPACT Anforderungen hergestellten Produkts. Proben dieser Chargen können bereits für Qualifizierungszecke angefordert werden. Die Emprove® Dossiers, die mit unseren Produkten geliefert werden, enthalten sämtliche Informationen, die zum Einreichen bei den Regulierungsbehörden benötigt werden. Die toxikologischen Informationen sind ebenfalls jederzeit verfügbar.
Ich möchte Deviron® testen, mir fehlt aber das nötige Know-how; wie können Sie mich unterstützen?
Zur Unterstützung bei der Anwendung können Sie sich auf unser Team von Biomanufacturing-Experten verlassen, die Sie bei dieser Umstellung begleiten. Wenden Sie sich für die kostenlose Unterstützung an Ihren Ansprechpartner bei Merck.
Was ist der Unterschied zwischen MQ400/Emprove® Evolve und MQ500/Emprove® Expert (GMP)?
Um Sie bei der Einreichung bei den Aufsichtsbehörden zu unterstützen, haben wir verschiedene Dokumentations- und Qualitätsprogramme erstellt, die Ihnen helfen, das richtige Produkt für die richtige Anwendung zu erhalten. Klicken Sie auf die folgenden Links, um mehr über die Emprove® und M-Clarity® Programme zu erfahren. Deviron® C16 Emprove® Evolve und Deviron® 13-S9 Emprove® Expert gehören zu den höchsten Qualitätsstufen, die wir anbieten.
Was sind die empfohlenen Konzentrationen für die Zielanwendungen?
Für die Virus-Inaktivierung ist das für TRITON™ X-100 verwendete ASTM3 E3042-16 auch heute noch das Dokument der Wahl für die Herstellung monoklonaler Antikörper. Je nach Anwendung variieren die in der Industrie verwendeten Konzentrationen zwischen 0,5 % und 1 %.
Für Zelllyseanwendungen wird eine große Spannbreite an Konzentrationen verwendet, die alle prozessspezifisch sind. Wir würden empfehlen, während der Prozessentwicklung mehrere Konzentrationen parallel auszuprobieren. Unsere Deviron® Detergenzien sind mindestens genauso wirksam wie TRITON™ X-100 oder Polysorbate.
Können wir eine GMP-konforme Nachweismethode für Deviron® entwickeln?
Unsere Experten in der Forschung und Entwicklung haben Nachweismethoden für unser Deviron® Portfolio entwickelt, die an unsere Kunden weitergegeben werden können. Für GMP-gerechte Nachweismethoden ist jedoch unser BioReliance® Labor der Partner der Wahl. Bei Fragen können Sie sich gerne an uns wenden.
Ist das Deviron® Portfolio für Zelllyseanwendungen mit Benzonase® kompatibel?
Benzonase® ist der Goldstandard für den DNA-Abbau in AAV4-Prozessen. Das Deviron® Portfolio wurde für die vollständige Kompatibilität mit Benzonase® Endonukleasen entwickelt. Es kommt zu keinem Verlust bei der Enzymaktivität oder bei den Detergenseigenschaften, wenn die beiden Portfolios in Kombination verwendet werden. Anwendungsdaten sind in der Broschüre des Deviron® Portfolios enthalten.
Wie groß ist die Herstellungskapazität für das Deviron® Portfolio?
Das Deviron® Portfolio wird von unserem Standort Darmstadt in Deutschland auf den Markt gebracht; wir können bereits mehr als 100 Tonnen des Produkts pro Jahr anbieten. Sie können uns gerne eine Prognose vorlegen, um fallspezifische Lieferzeiten zu besprechen.
1Europäische Chemikalienagentur
2Registration, Evaluation, Authorization and Restriction of Chemicals (Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe)*
3American Standard for Test Method
4Adeno-assoziiertes Virus
TRITON ist eine Marke von The Dow Chemical Company („Dow“) oder eines Tochterunternehmens von Dow und wird unter Lizenz verwendet.
Literatur
Wir informieren und beraten unsere Kunden nach bestem Wissen und Gewissen, jedoch unverbindlich und ohne Haftungsübernahme. Bestehende Gesetze und Vorschriften sind von unseren Kunden in jedem Fall zu beachten. Dies gilt auch im Hinblick auf etwaige Rechte Dritter. Unsere Informationen und Beratung entbinden unsere Kunden nicht von der eigenverantwortlichen Prüfung unserer Produkte auf ihre Eignung für den beabsichtigten Zweck.
Um weiterzulesen, melden Sie sich bitte an oder erstellen ein Konto.
Sie haben kein Konto?