甜味食品所帶來的愉悅感覺所產生的強大效果,導致了消費者對蔗糖和果糖這兩種熱量甜味劑的需求和大規模生產。由於經濟因素和糖的短缺,消費者對替代甜味劑的需求在第二次世界大戰期間出現。在這段期間,美國密蘇裏州聖路易斯的一家小型諮詢公司開發了糖精生產工藝,以滿足消費者對替代甜味劑的需求。糖精作為這家公司的突破性產品,它的成功創建了 Sigma-Aldrich® Corporation 公司。隨著雀巢等商業食品供應商建立感官研究合作關係,以開發客製化食品,滿足特定客戶的口味偏好,同時提供最佳的營養效益,這種對替代甜味劑的需求持續增長。
隨著甜味感知的新發現,可忽略熱量貢獻且口味理想的新型天然、合成和半合成甜味劑替代品將繼續擴展。第一代甜味劑替代品包括合成甜味劑糖精、甜蜜素和阿斯巴甜。這些化合物已在動物模型中研究過其致癌性,但新一代的合成甜味劑安赛蜜-K、新橙皮甙、阿立甜和三氯蔗糖並未被懷疑會致癌,也不具基因毒性。
哺乳類的甜味感知
人類對甜味的味覺模式最初被認為與獨特的、區域性的舌頭組織位置相關。
在人類中,嗅覺反應直接從臭味劑到神經反應,但是味覺反應則從味道劑和味道受體之間的互動到神經反應。味覺感受器細胞聚集在沿著整個人類口腔的顎部和舌部位置分佈的味蕾中。1 這些味覺細胞內的受體蛋白與甜味配體結合,通過活化的突觸引起下游信號傳遞連鎖反應,激發感官神經纖維將信號傳送到大腦進行中樞味覺處理。3 而Heath et al.4
小鼠基因組中的糖精偏好(Sac)位點是一個與天然糖和合成甜味劑的甜味變異相關的位點。有幾個研究小組成功地在 Sac 位點附近搜尋到負責人類甜味感知的基因。例如,Bachmanov et al. 使用定位克隆方法鑒定了編碼 G 蛋白耦合受體 T1R3 的基因 Tas1r3 。5 另一項研究證實 Sac 位點編碼哺乳類動物的 T1R3,但也顯示第二個受體 T1R2 與 T1R3 結合來偵測甜味。6 T1R2和T1R3之間形成的結構是一個異二聚體,至少有四個甜味劑結合位點,其中包括一個特殊的結合位點,能容納甜味蛋白質。7
結晶學已被用來確定甜味蛋白質與這個特殊結合位置的結合特性,結合位置是透過計算各種分子甜味劑的自由能來確認的。8-10 與蔗糖和其他低分子量甜味劑(包括糖精和甜菊糖苷)不同,核黃素結合蛋白(RBP)以獨立於核黃素的方式抑制這些蛋白質的甜味特性。11 RBP 抑制是 RBP 與甜味受體結合的結果,而不是 RBP 介導的甜味蛋白降解。12 Monellin 是表 1 中描述的幾種甜味蛋白之一。
某些甜味劑之間的協同作用被懷疑是由於多種但獨特的甜味劑根據最佳甜味劑構象和分子大小結合在相同的受體上,但結合的位點不同。例如,類黃酮甜味劑新橙皮甙二氫查爾酮能與人類 T1R3 的七螺旋結構域結合,但不能與大鼠 T1R3 結合。15
T1R3 和 T1R2 受體各自由七個跨膜的α-螺旋段組成。16 當細胞外的甜味劑與 T1R2/T1R3 異質二聚體結合時,會發生構象改變,讓細胞內的 G 蛋白與受體互動。17 耦合的G蛋白尚未被清楚地確定;然而,苦味和甜味細胞都與G蛋白α-gustducin有關。α-gustducin和T1R受體的不同共同表達顯示,α-gustducin在某些情況下可能是負責甜味感知的G蛋白,但不是所有情況。不同的味覺細胞位置有不同的 α-gustducin 和受體共表達模式;舌味覺細胞的共表達比顎味覺細胞少。在一項特定的小鼠研究中,T1R2陽性的顎味覺細胞有38%的gustducin共表達率,而T1R3陽性的顎味覺細胞有100%的gustducin共表達率。18
甜味劑與GPCR結合後,G蛋白會啟動下游轉導級聯(圖1)。19 如果甜味劑是碳水化合物,cAMP 第二信使會改變細胞內的鈣離子濃度,並從細胞外空間吸收鈣。相反,如果甜味劑是合成化合物,鈣會透過磷脂酶 C 介導的磷脂酰肌醇脂質轉換為二酰甘油和三磷酸肌醇 (IP3) 從細胞內儲存釋放出來。6,20 合成甜味劑觸發級聯中的中間步驟尚未完全明瞭,不過,使用 PKC 抑制劑雙吲哚馬來酰亞胺 (BIM) 進行的抑制研究顯示,蛋白激酶 C (PKC) 已經活化。
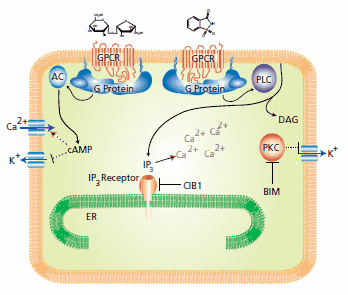
圖 1.碳水化合物蔗糖(左)的機制與合成甜味劑糖精(右)的機制不同。具體解釋請參閱正文。
這些信號傳遞連鎖反應會導致鉀離子外流、鉀導通抑制和膜去極化。細胞內鈣濃度的增加是突觸活化和神經纖維興奮所需要的。研究人員利用 RNA 干擾找到了一種 T1R2/T1R3 互作蛋白,命名為鈣與整合素結合蛋白 1 (CIB1),它在味覺信號轉導中可作為 IP3 依賴性鈣釋放的體內抑制劑。22
目前的甜味劑替代品
甜蛋白質、植物萃取物和糖醇等天然甜味劑的替代品,因其最佳的物理特性(如熔點)和有益的生理特性而受到進一步的研究、熔點)和有益的生理影響,以確定它們是否適合作為長期的糖替代品。甜菊糖苷是 Bertoni 植物(Cat. S5381),最近引起了媒體的關注,因為 Cargill™® 合作,向美國消費者推出了甜菊糖粉末配方,稱為 Truvia™。然而,甜菊糖甙在美國尚未被用作食品添加劑;美國食品和藥物管理局尚未授予它一般認為安全 (GRAS) 的地位。據報導,甜菊糖甙和甜菊糖甙 A(甜菊糖甙的第二種糖苷成分)的毒性水平非常低,甚至可以忽略不计,因此該地位可能會被修訂。23,24
人們對甜菊糖的興趣日益濃厚,不僅是因為它具有天然的甜味特性,還因為它具有抗氧化、免疫調節、25 和抗癌活性。 體外 監測甜菊糖甙和甜菊二糖甙 A 治療的研究表明,甜菊糖甙和甜菊二糖甙 A 可增強葡萄糖依賴性胰島素的分泌。這是一種有益的結果,可以抵消因長期使用磺脲類藥物治療糖尿病而導致的胰島素分泌減少。26,27 甜菊糖的代謝物甜菊醇具有免疫調節和抗癌活性。具體而言,研究顯示甜菊醇可抑制 TNF-α 誘發的 IL-8 在人類結腸癌細胞株上的釋放。由於甜菊醇是在盲腸或結腸中形成的,因此它在平衡結腸細胞發炎和分泌反應方面的用途將喚起持續的研究興趣。28
如前所述,甜蛋白質具有用於替代蔗糖和果糖的潛力。甜味蛋白是具有獨特序列組成和結構變異的天然蛋白質,能給人類、猿類和舊世界猴子帶來強烈的甜味感覺,但並非所有哺乳類動物都有這種感覺。29 甜味蛋白是一種理想的甜味劑替代品,因為它們無毒(基於動物模型證據),而且沒有下游的胰島素反應。31
另外,有幾種 L-氨基酸能引起人類的甜味感知。使用味覺厭惡試驗方法,可以確定小鼠能夠從 L-絲氨酸和 L-蘇氨酸中分辨出蔗糖。32
在過去的十年中,參與甜味感知的配體、受體和傳導參與者的揭開代表了對人類化學感知研究的重大貢獻。這類研究增加了對人類根據化學、情緒和物理感覺輸入做出決策的整體理解。化學感知研究與商業企業的交叉將帶來新型食品替代品的供應,並有可能阻止糖尿病和肥胖症患者人數的不斷增加。
參考資料
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?