在過去的 100 年中,細胞培養已從實驗室的好奇心,演變成一種有價值且被廣泛使用的研究與生物製造工具。在這段期間,用來培養細胞的表面也隨著研究人員需求的改變而演變。從 1907 年 Ross Harrison 開創青蛙培養法到 1940 年代,大多數細胞都是以外植體培養法,在血漿凝塊上進行懸滴培養或在PYREX® 玻璃瓶和培養皿底部進行培養。到了 1950 年代中期,小鼠 L 細胞 (1943 年) 和人類 HeLa 細胞 (1951 年) 兩種細胞系的出現,以及胰蛋白酶最初用於將細胞培養成單細胞懸浮液,使得大部分細胞都在玻璃瓶和培養皿中作單層培養。1954 年,多倫多 Connaught 醫學研究實驗室的研究人員在 5L PYREX Povitsky 燒瓶中培養猴腎細胞,為 Jonas Salk 成功的小兒麻痺病毒疫苗培養病毒。這是第一次使用細胞培養法製造商業產品。這些突破,加上現代合成細胞培養基的發展,如 M199(1950 年,用於脊髓灰質炎疫苗項目)和 Eagle 廣泛使用的 Minimum Essential Medium(1959 年),使細胞培養作為研究和生產工具的使用開始急劇上升。
然而,許多細胞,尤其是原代細胞培養物,難以附著在玻璃上,因此 George Gey 在 1956 年使用鼠尾膠原蛋白塗佈在玻璃表面,以改善細胞的附著與生長。此外,玻璃培養容器需要非常小心的清洗程序,以確保清潔劑殘留物不會干擾這些和其他細胞過程。因此,研究人員開始嘗試使用拋棄式塑膠培養容器,包括最早的微孔板。到了 1960 年代,塑料烧瓶、培养皿和 96 孔板都可以在市场上买到。這些容器大多由聚苯乙烯製成,聚苯乙烯是一種長碳鏈聚合物,每隔一個碳就有一個苯環。之所以選擇聚苯乙烯,是因為它有極佳的光學清晰度,容易成型,而且可以用輻照消毒。然而,它也有一個顯著的缺點:它是一種非常疏水(不濕潤)的聚合物,細胞很難附著在上面。為了使細胞附著良好,必須將疏水性的聚苯乙烯表面改質為較親水的表面。這可讓含有血清的培養液中的細胞附著蛋白(vitronectin 和 fibronectin)附著並在容器底部擴散,從而提供更好的表面讓細胞附著。新成型的聚苯乙烯表面會使用大氣條件下的電暈放電或真空條件下的氣體等離子處理。這些過程都會產生高能氧離子,氧化並接枝到表面的聚苯乙烯鏈上(圖 1),因此一旦加入培養基,表面就會變得親水且帶負電。1-4 到了 1970 年代中期,大多數研究人員都在處理過的聚苯乙烯容器中培養細胞,而不是玻璃容器。

圖 1.聚苯乙烯可透過加入各種不同的化學基團、打破碳鏈骨架或打開苯環來進行表面改性(未顯示)。
到了20世紀70年代末,研究人員發現即使是處理過的聚苯乙烯也有其局限性,尤其是在無血清培養基培育細胞以及在原代培養物和細胞系中維持分化細胞功能方面。5 由於這項工作,一些細胞研究人員開始在培養容器表面塗上塗層,以改善細胞附著和性能。他們使用各種生物材料,包括細胞外基質、附著和黏附蛋白,例如膠原蛋白、層黏蛋白和纖維連結素,以及黏多醣,例如硫酸肝素、透明質酸和硫酸軟骨素,既可以單獨使用,也可以混合使用。使用基本合成聚合物(如聚 D-赖氨酸 (PDL))作為塗層,也可在聚苯乙烯上產生正電荷,對某些細胞類型而言,可增強細胞的附著、生長和分化,尤其是在無血清和低血清條件下。PDL 塗層通常可改善原代神經元、膠質細胞、神經母質瘤以及各種轉染細胞株的附著與生長。PDL 塗層也用於以細胞為基礎的微孔板分析,幫助細胞在處理過程中保持附著於孔底。
Corning® CellBIND® 表面
由於生物塗層價格昂貴、批次間的差異性大,且具有傳播危險生物製劑的潛在風險,康寧® CellBIND®培養表面於2003年推出,以改善困難條件下的細胞附著,例如使細胞適應無血清培養基或恢復冷凍細胞。此專利處理程序(美國專利 6,617,152)由康寧科學家開發,與傳統等離子或電暈放電處理的表面相比,此專利處理程序使用較高能量的微波等離子,在聚苯乙烯表面加入更多氧氣,使其更具親水性(可濕潤),同時增加表面的穩定性。
與生物塗層不同的是,Corning® CellBIND®表面不需要特殊的處理或儲存,而且由於聚苯乙烯是經過處理而非塗層,因此表面也更為一致和穩定。與傳統處理過的聚苯乙烯表面相比,康寧®CellBIND®表面對於難以附著的細胞株,特別是轉染細胞,提供更快速、一致且均勻的細胞附著。6 它也可以減少細胞過早脫離融合的培養物,特別是在滾動瓶中和以細胞為基礎的實驗中。這種增強的細胞性能使生物技術公司使用康寧滾動瓶與康寧® CellBIND®表面生產FDA批准的蛋白治療劑和疫苗。
在從冷凍培養物中恢復細胞時,良好的細胞附著尤其重要,因為附著不良會導致未附著的細胞凋亡和壞死,造成培養物恢復速度減慢和研究時間損失。這一點在(圖 2)使用 LNCaP 細胞進行的實驗中得到了證明,LNCaP 是一種前列腺癌細胞系,由於其附著性差,通常難以培養。康寧®CellBIND®表面可改善解凍後的細胞附著性,從液氮儲存中顯著改善 LNCaP 細胞的附著性和產量。

圖 2.左圖:解凍 24 小時後,LNCaP 細胞在康寧 CellBIND 表面的附著力比標準細胞培養表面高 49%。右圖7 天後 LNCaP 細胞的產量比標準細胞培養表面高出 69%。輸入細胞數是小瓶中的細胞數。數據為 3 個獨立實驗的平均值 ± 標準誤差。

圖 3.在 Ultra-Web 奈米纖維表面生長的 NG108 神經細胞。這種表面類似於膠原蛋白和其他 ECM 表面,但完全是合成的。由於其孔隙較小,細胞會在表面生長,而不是在其中生長。
Ultra-Web®表面已成功用於生長各種類型的細胞,包括肝臟、腎臟、神經元和幹細胞。8-10這種新型合成表面已在多種基於細胞的檢測中進行了測試,包括基於細胞的發光報告基因和FLIPR鈣通量檢測。由於細胞在 Ultra- Web 表面生長,因此染色後很容易觀察 (圖 4),而且可以使用標準方法採集細胞。

圖 4.Ultra-Web 表面與螢光共焦顯微鏡相容。這些在 Ultra-Web (左) 和 Ultra-Web Polyamine (右) 表面培養 18 天的原代皮層神經元具有明顯的三維形態,並保持了長期的神經元活力。使用 Neurite Outgrowth HCS HitKit (Cellomics) 對細胞進行染色,並使用倒置螢光顯微鏡搭配適當的濾光片進行觀察(細胞體/中胚層 = 綠 = b-III-tubulin,細胞核 = 藍 = Hoechst 染料)。
肝細胞培養物在 Ultra-Web® 表面的表現特別好。10 人類原代肝細胞在 10 天內顯示出與膠原蛋白 I、IV、層壓蛋白相等的白蛋白產量,而在未塗層的 TCT 微板上則顯示出更高的產量(數據未顯示)。使用基於螢光的檢測,與培養在塗有膠原或膠原夾層的微板上的肝細胞相比,這些肝細胞也顯示出增強的細胞色素 P450 (CYP1A2) 活性(圖 5)。用 50μM 奧美拉唑誘導 CYP1A2 活性三天,然後用 10μM 的螢光底物 Ethoxyresorufin 取代培養基,並測量螢光。在 Ultra- Web® 和 Ultra-Web® 聚胺微孔板表面培養的肝細胞,其原始 P-450 活性 (藍條) 和 Cyp1A2 的誘導倍數 (藍線) 是膠原蛋白的近兩倍,與 Matrigel 相似。因此,合成 Ultra-Web® 表面提供了在三維表面上培養細胞的另一種方法,而不會產生與生物塗層相關的任何問題。
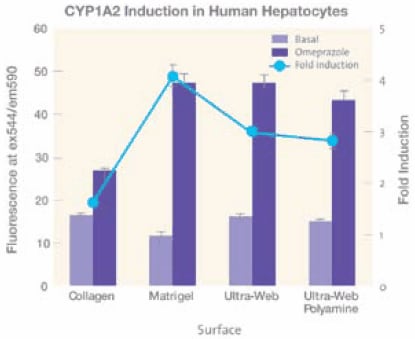
圖 5.四種不同的細胞培養表面,膠原蛋白 I 和 Matrigel™ (BD)、Ultra-Web 和 Ultra-Web 多胺表面 (Corning) 對人類原代肝細胞 CYP1A2 活性的影響。Ultra-Web 表面的表現優於膠原蛋白,與 Matrigel 相似,但基礎活性較高。
超低附著表面
有時研究人員想要培養細胞,防止細胞附著在培養表面是一個優點。未處理的聚苯乙烯培養容器通常會先試用,希望其疏水性表面能防止細胞附著。然而,部分原因是由於它們經過輻照消毒,這些未經處理的容器仍可透過疏水作用結合附著蛋白以及某些細胞類型。為了盡可能減少細胞附著,康寧® 在1990年代推出了超低附著表面塗層的容器。這些血管具有非常親水且帶中性電荷的水凝膠層,直接共價連結至聚苯乙烯表面以防止剝落。由於細胞附著蛋白和其他生物分子會透過疏水或離子互動作用被動地吸附在聚苯乙烯表面,因此這種水凝膠表面自然會透過這些力量抑制非特異性固定,進而抑制後續的細胞附著。
由於這些特性,超低附著力表面可抑制巨噬細胞和中性粒細胞的附著和活化。11 此表面也可防止正常的錨附依賴細胞附著,這通常會導致它們凋亡。不依賴固定的細胞,例如腫瘤細胞或成體幹細胞,在超低附著力表面培養時會以固定的懸浮培養物生長,通常會形成無附著的球體(圖 6)。這種能力使超低附著力表面血管成為從腦部和乳腺組織分離原發腫瘤和幹細胞球體的理想選擇12-16 並有助於避免正常細胞的過度生長,因為正常細胞會發生凋亡。超低附著力表面也建議用於從胚胎幹細胞培養未附著、易於收穫的類胚體17

圖 6.C6 神經膠質瘤細胞的單細胞衍生菌落在標準組織培養處理的容器中形成扁平的附著菌落(左圖),但在康寧超低附著力表面(右圖)形成未附著的球體。
參考資料
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?