Oczyszczanie białek błonowych
Białka błonowe są zwykle oczyszczane jako kompleksy białkowo-lipidowo-detergentowe. Rozpuszczalność kompleksów w środowisku wodnym pozwala na zastosowanie zasadniczo tych samych technik separacji, co w przypadku białek rozpuszczalnych w wodzie. Główną różnicą jest to, że oczyszczanie białek błonowych przeprowadza się z detergentem obecnym we wszystkich roztworach. Jest to konieczne, ponieważ kompleksy białko-detergent są dynamiczne i natychmiast utraciłyby cząsteczki detergentu w przypadku braku wolnego detergentu. Stężenie detergentu powinno być powyżej CMC, ale może być około 10 razy niższe niż to, które było używane podczas solubilizacji (zwykle w zakresie 0,1%).
Wysokie stężenia detergentu mogą zmniejszyć stabilność białka. Jednak stężenia detergentów muszą być wysokie podczas solubilizacji, jeśli stężenie składników błony jest wysokie. Po zakończeniu solubilizacji stężenie detergentu można zmniejszyć. Detergenty są często drogie i przydatne jest również ograniczenie zużycia ze względu na koszty.
Nadmierne oczyszczanie może prowadzić do usunięcia niezbędnych lipidów z kompleksu białkowo-lipidowego detergentu z jednoczesną utratą aktywności białka.
Stabilność białka błonowego można często poprawić, stosując 5% glicerol we wszystkich buforach podczas całego procesu oczyszczania.
Puryfikacja białek błonowych znakowanych histydyną
.Białka znakowane histydyną mają powinowactwo do Ni2+ i kilku innych jonów metali, które można unieruchomić na podłożach chromatograficznych za pomocą ligandów chelatujących. W związku z tym białko zawierające znacznik histydynowy będzie selektywnie wiązane z podłożami naładowanymi jonami metali, takimi jak Ni Sepharose High Performance (HP) i Ni Sepharose 6 Fast Flow (FF), podczas gdy większość innych białek komórkowych nie będzie się wiązać lub będzie się wiązać słabo. Elucję uzyskuje się poprzez zwiększenie stężenia imidazolu. Ta technika chromatograficzna jest często określana jako immobilizowana chromatografia jonów metali (IMAC).
Rozpuszczalne w wodzie białka znakowane (histydyną)6 są zwykle łatwe do oczyszczenia zgodnie ze standardowymi protokołami. Białka błonowe znakowane histydyną są czasami bardziej problematyczne, a słabe wiązanie z mediami IMAC jest często zgłaszane. Spekuluje się, że jest to spowodowane ograniczoną dostępnością znacznika histydynowego dla ligandu IMAC z powodu wiązania detergentu z białkiem. Aby rozwiązać ten problem, dłuższe znaczniki histydynowe są rutynowo stosowane do nadekspresji białek błonowych. Zasugerowano również obecność łącznika, takiego jak zielone białko fluorescencyjne (GFP), między znacznikiem histydynowym a docelowym białkiem błonowym w celu poprawy wiązania z mediami IMAC.
Historycznie, oczyszczanie partiami było często stosowane do oczyszczania białek błonowych znakowanych histydyną. Oczyszczanie wsadowe polega na mieszaniu próbki z medium chromatograficznym w otwartym naczyniu przez określony czas, często przez noc. Zawiesina jest następnie pakowana do kolumny w celu przemycia i elucji związanego białka. Oczyszczanie wsadowe może czasami poprawić wydajność, ponieważ czasy adsorpcji są dłuższe niż w przypadku separacji kolumnowej. Z drugiej strony, ponieważ procedura wsadowa jest dłuższa, pozostawia również białko bardziej narażone na degradację proteolityczną lub inaktywację, a tym samym może pogorszyć jakość oczyszczonego białka.
Oczyszczanie białek błonowych znakowanych histydyną można również przeprowadzić przy użyciu metod kolumnowych.
W zależności od poziomu czystości wymaganego do ostatecznego zastosowania, po IMAC można przeprowadzić dodatkowe etapy oczyszczania. W tym celu najczęściej stosowana jest filtracja żelowa, której zaletą jest to, że optymalizacja zwykle nie jest potrzebna. Chromatografia anionowymienna może być również stosowana i jest często włączana między etapy IMAC i filtracji żelowej.
Purifikacja białka błonowego znakowanego histydyną z rozpuszczonego, wyizolowanego materiału frakcji błony
Materiał
Kolumna: HisTrap HP, 1 mL
Bufor wiążący: PBS, 20 mM imidazol, 0,1 do 1% detergent (np. DDM), pH 7,4
Bufor elucyjny: PBS, 0,5 M imidazol, 0,1 do 1% detergent (np., DDM), pH 7,4
Przygotowanie próbki
Do 5 ml rozpuszczonego białka błonowego dodać 0,20 ml buforu elucyjnego, aby uzyskać końcowe stężenie imidazolu 20 mM.
Puryfikacja
Tę procedurę oczyszczania należy przeprowadzić w temperaturze 4 °C.
- Napełnij strzykawkę lub rurkę pompy wodą destylowaną. Zdejmij zatyczkę i podłącz kolumnę do strzykawki (użyj dołączonego złącza), pompy laboratoryjnej lub systemu chromatograficznego "kropla do kropli", aby uniknąć wprowadzenia powietrza do systemu.
- Usuń zatrzask na wylocie kolumny.
- Umyć etanol za pomocą 3 do 5 objętości kolumny (CV) wody destylowanej.
- Wyrównać kolumnę za pomocą 10 CV buforu wiążącego przy szybkości przepływu 1 ml/min*
- Nałożyć próbkę (za pomocą strzykawki przymocowanej do złącza Luer lub pompując ją na kolumnę). Stosować szybkość przepływu 1 ml/min.
- Płukać 10 CV buforu wiążącego przy szybkości przepływu 1 ml/min.
- Elucja gradientem od 0% do 75% buforu elucyjnego w 20 CV przy szybkości przepływu 1 ml/min. Gdy używana jest strzykawka, eluować stopniowo z kolejnymi wyższymi stężeniami imidazolu.
- Po elucji przemyć kolumnę buforem elucyjnym 5 CV 100%, a następnie buforem wiążącym 5 CV.
*Jeden ml/min odpowiada około 30 kroplom/min, gdy używana jest strzykawka z kolumną HiTrapTM 1-mL. W przypadku korzystania z większej kolumny można zastosować wyższą szybkość przepływu. Patrz instrukcje dotyczące kolumny.
Procedura może być skalowana poprzez połączenie dwóch lub trzech kolumn szeregowo lub przy użyciu kolumn HisTrap HP 5 ml.
Zalecane jest stosunkowo niskie stężenie NaCl (np. PBS to 150 mM NaCl), ponieważ białka błonowe są zwykle mniej rozpuszczalne przy wyższych stężeniach jonów. Wyższe stężenia (np. 300 do 500 mM NaCl) są często zalecane do IMAC białek rozpuszczalnych w wodzie w celu zmniejszenia interakcji jonowych zanieczyszczeń z medium chromatograficznym. W niektórych przypadkach, nawet niższe stężenia NaCl (np. 150 mM) powinny być stosowane dla białek błonowych. Alternatywnie, stężenie NaCl można zmniejszyć bezpośrednio po etapie IMAC poprzez odsolenie materiału za pomocą kolumny HiTrap Desalting.
Odnotowano, że stosując elucję gradientową (ze wzrostem stężenia imidazolu) z kolumny IMAC, jak w powyższym protokole, można rozdzielić kompleksy białko-lipid-detergent, które różnią się jedynie zawartością lipidów.
Powtórne zastosowanie materiału przepływowego, po kroku 5 powyżej, aby umożliwić kilkakrotne przejście próbki przez kolumnę IMAC, może być przydatne w celu maksymalizacji wydajności.
Wydajność można również zwiększyć, zmniejszając szybkość przepływu podczas ładowania próbki.
Do dalszego oczyszczania często odpowiednia jest chromatografia jonowymienna i/lub filtracja żelowa (patrz "Dodatkowe etapy oczyszczania" w tej sekcji).
Rysunek 1.9 przedstawia oczyszczanie YedZ-TEV-GFP-(His)8 przy użyciu powyższego protokołu. YedZ jest białkiem błonowym transportera z E. coli, które było nadeksprymowane w E. coli jako białko fuzyjne z GFP, C-końcowym znacznikiem (histydyna)8 i sekwencją cięcia proteazy wirusa tytoniu (TEV).
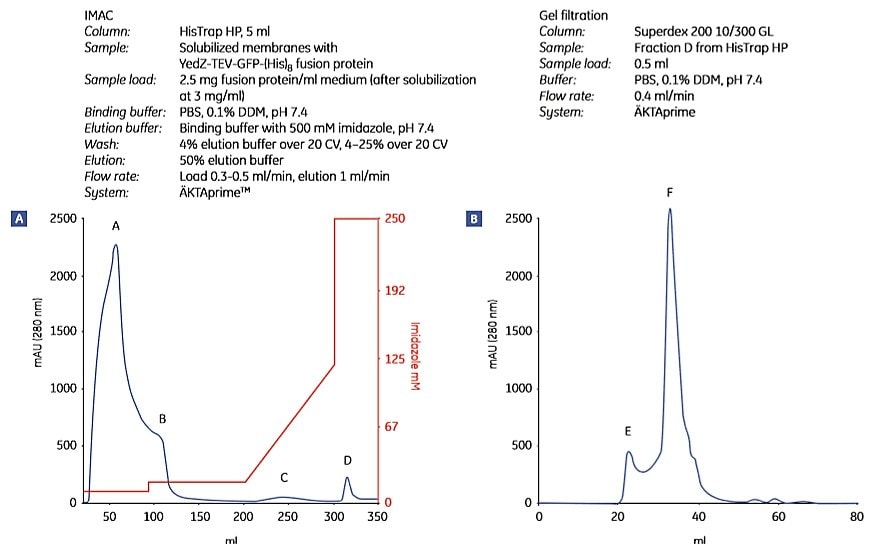
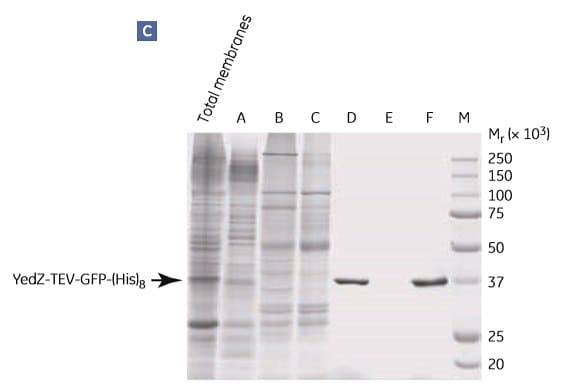
Rysunek 1.9.Dwuetapowe oczyszczanie E. coli YedZ-TEV-GFP-(His)8 z rozpuszczonych błon przygotowanych z hodowli komórkowej E. coli. Frakcje z (A) IMAC były dalej oczyszczane przez (B) filtrację żelową. (C) Analiza SDS-PAGE wybranych frakcji pokazuje czystość białka docelowego. Frakcja D z kolumny HisTrap HP była zasadniczo jednorodna. M = marker masy cząsteczkowej. Pik E najprawdopodobniej zawierał rozpraszające światło agregaty detergentowo-lipidowe. Dane uprzejmie dostarczone przez dr Davida Drew, Centrum Badań Biomembranowych, Uniwersytet Sztokholmski, Sztokholm, Szwecja.
Purifikacja białka błonowego znakowanego histydyną bezpośrednio z surowego, rozpuszczonego lizatu E. coli
Ten protokół omija potrzebę przygotowania membrany i wirowania. Wykorzystuje on kolumnę chromatograficzną, która została zaprojektowana do stosowania nieklarowanego surowego lizatu komórkowego.
Materiały
Kolumna: Surowy HisTrap FF, 1 ml
Bufor wiążący: PBS, 40 mM imidazol, 0,1% detergent (np. DDM), pH 7,4
Bufor elucyjny: PBS, 1 M imidazol, 0,1% detergent (np., DDM), pH 7,4
Przygotowanie próbki
Zawiesić pastę komórkową E. coli przez dodanie 5 ml PBS z 40 mM imidazolem na każdy gram pasty. Przeprowadzić lizę komórek za pomocą lizozymu i sonikacji (Tabela 1.2). Dodaj detergent do nieklarowanego lizatu ze stężonego roztworu (np. DDM do końcowego stężenia 0,8%). Mieszać na lodzie przez 1,5 godziny.
Purifikacja
- Napełnić rurkę pompy lub strzykawkę wodą destylowaną. Zdejmij zatyczkę i podłącz kolumnę do rurki systemu chromatograficznego, strzykawki (użyj dołączonego złącza Luer) lub pompy laboratoryjnej "kropla do kropli", aby uniknąć wprowadzenia powietrza do systemu.
- Usuń zatrzask na wylocie kolumny.
- Wymyć etanol za pomocą 3 do 5 CV wody destylowanej.
- Kalibrować kolumnę za pomocą 10 CV buforu wiążącego przy szybkości przepływu 1 mL/min*
- Załadować oczyszczony detergentem, nieklarowany lizat za pomocą pompy (0,5 mL/min) lub strzykawki. Objętość załadunku niesklarowanego lizatu zależy w dużym stopniu od każdej konkretnej próbki.
*Jeden ml/min odpowiada około 30 kroplom/min przy użyciu strzykawki z kolumną HiTrap 1 ml. W przypadku korzystania z większej kolumny można zastosować wyższą szybkość przepływu. Patrz instrukcje dotyczące kolumny
Zaleca się ciągłe, delikatne mieszanie próbki podczas jej ładowania, aby zapobiec sedymentacji. Ładowanie próbki w temperaturze 4 °C może zwiększyć lepkość próbki. Niekorzystnym skutkiem zwiększonej lepkości próbki jest to, że maksymalne przeciwciśnienie dla kolumny jest osiągane przy mniejszej objętości próbki ładowanej do kolumny. Duże objętości mogą zwiększać przeciwciśnienie, co utrudnia użycie strzykawki.
- W zależności od objętości próbki (większe objętości próbki wymagają większych objętości płukania), przemyć 10 do 30 CV buforu wiążącego przy szybkości przepływu 1 ml/min.
- Elucja gradientem od 0% do 12% buforu elucyjnego w 10 CV, a następnie od 12% do 100% buforu elucyjnego w 5 do 10 CV, wszystko z szybkością przepływu 1 ml/min. Gdy używana jest strzykawka, eluować stopniowo z kolejnymi wyższymi stężeniami imidazolu.
- Po elucji przemyć kolumnę buforem elucyjnym 5 CV, a następnie buforem wiążącym 5 CV.
Rysunek 1.10 przedstawia oczyszczanie YedZ-TEV-GFP-(His)8 przy użyciu powyższego protokołu.
Do dalszego oczyszczania często odpowiednia jest chromatografia jonowymienna i filtracja żelowa (patrz "Dodatkowe etapy oczyszczania" w tej sekcji).
Procedurę można zwiększyć, łącząc dwie lub trzy kolumny szeregowo lub stosując surowe kolumny HisTrap FF o pojemności 5 ml.

Rysunek 1.10.Oczyszczanie białka błonowego znakowanego (histydyną)8, YedZ-TEV-GFP-(His)8 bezpośrednio z surowego, rozpuszczonego lizatu E. coli przy użyciu HisTrap FF crude, 1 ml. Frakcje szczytowe 14 i 15 analizowano metodą SDS-PAGE. Żel został zeskanowany w celu wykrycia części GFP białka fuzyjnego. Strzałka wskazuje pasmo odpowiadające YedZ-TEV-GFP-(His)8. Na chromatogramie niebieski = A280; pomarańczowy = A425 (do wykrywania YedZ); zielony = A485 (do wykrywania GFP); szary = przewodnictwo; czerwony = % buforu elucyjnego. Wektor do nadekspresji został uprzejmie dostarczony przez dr J.-W. deGier, Centre for Biomembrane Research, Sztokholm, Szwecja.
Dodatkowe etapy oczyszczania
Dalsze oczyszczanie oczyszczonego IMAC, znakowanego histydyną białka błonowego jest zwykle konieczne do zastosowań wymagających wysoce czystego jednorodnego materiału (np. do charakterystyki strukturalnej). Jeden lub dwa dodatkowe etapy chromatograficzne są zazwyczaj wystarczające. Aby uzyskać maksymalną wydajność, schemat oczyszczania powinien być zaprojektowany tak, aby różne zasady separacji były wykorzystywane w różnych etapach.
Wysoce wydajny schemat oczyszczania może składać się z IMAC (rozdzielanie zgodnie z przynależnością gatunkową), a następnie odsalania i wymiany jonowej (rozdzielanie zgodnie z różnicami ładunku), a na koniec przez filtrację żelową (rozdzielanie zgodnie z różnicami wielkości). Żelowa filtracja jest najczęściej stosowana jako ostatni etap w celu ostatecznego usunięcia agregatów i przeniesienia próbki do buforu odpowiedniego do dalszych badań funkcjonalnych i strukturalnych. Separacje przeprowadza się w obecności detergentu powyżej CMC (zwykle około 0,1%). Inne warunki są takie same jak dla białek rozpuszczalnych w wodzie. Niektóre odpowiednie kolumny są wymienione w Tabeli 1.6. System chromatografii ÄKTAxpress™ może być używany do automatyzacji wieloetapowego oczyszczania w celu uzyskania białek o wysokiej czystości przy minimalnym czasie pracy.Wymiana anionowa o wysokiej rozdzielczości może być stosowana zarówno do oczyszczania, jak i charakteryzowania jednorodności ładunku oczyszczonych białek membranowych. W większości przypadków siła jonowa próbek z IMAC musi zostać zmniejszona przed zastosowaniem do chromatografii jonowymiennej. Rysunek 1.14 przedstawia charakterystykę ładunku oczyszczonego białka membranowego IMAC przy użyciu Mono Q™.
.

Rysunek 1.14.Charakterystyka jednorodności ładunku oksydazy ubichinolowej cytochromu bo3 znakowanej histydyną przy użyciu chromatografii anionowymiennej z Mono Q. Analizowano dwie frakcje uzyskane z oczyszczania IMAC. Analizę elektroforetyczną przeprowadzono za pomocą PhastSystemTM przy użyciu PhastGelTM 8-25% i barwienia srebrem. M = zestaw kalibracyjny o niskiej masie cząsteczkowej; E = detergentowy ekstrakt z błon E. coli; FT = materiał przepływowy; F1 = frakcja 1 z HiTrap Chelating HP 1 mL; F2 = frakcja 2 z HiTrap Chelating HP 1 mL. Patrz nota aplikacyjna 18-1128-92 Oczyszczanie i charakterystyka chromatograficzna integralnego białka błonowego".
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?