Terminy i obliczenia dotyczące inhibitorów enzymów
Czytaj dalej, aby poznać przydatne terminy i obliczenia dotyczące inhibitorów enzymów, zrozumieć kinetykę Michaelisa-Menten, w tym jak określić Km i Vmax, oraz jak dokładnie porównać enzymy pod względem wydajności katalitycznej.
- Przydatne terminy w badaniach nad inhibitorami enzymów
- Kinetyka Michaelisa-Mentena: Znaczenie Km i Vmax
- .Jak określić Km i Vmax
- Obliczanie wydajności katalitycznej w celu porównania enzymów
Przydatne terminy w badaniach nad inhibitorami enzymów
Niektóre specyficzne terminy są przydatne do zrozumienia podczas badań nad inhibitorami enzymów.
Km
Km to stężenie substratu, przy którym obserwuje się połowę maksymalnej prędkości reakcji w danym zestawie warunków (Rysunek 1). Jest to odwrotna miara siły wiązania między substratem a enzymem, gdzie niższe Km oznacza wyższe powinowactwo i niższe stężenie substratu jest wymagane do osiągnięcia maksymalnej szybkości reakcji. Wartości Km zależą od pH, temperatury i innych warunków reakcji.

Rysunek 1.Zależność między stężeniem substratu a maksymalną prędkością reakcji.
Vmax
Vmax to maksymalna prędkość reakcji w danych warunkach (Rysunek 1). Vmax jest osiągane, gdy wszystkie miejsca enzymatyczne są nasycone substratem. Dzieje się tak, gdy stężenie substratu [S] jest większe niż Km, tak że [S]/([S]+Km) zbliża się do 1.
EC50
EC50 określa skuteczność kliniczną leku i jest podawane jako stężenie leku wymagane do uzyskania 50% maksymalnego efektu (może to być efekt hamujący lub stymulujący). Odpowiedź hamująca znajduje się w połowie drogi między wartością wyjściową a maksymalną po ekspozycji na cząsteczkę hamującą przez wybrany okres czasu. Termin ten jest zwykle używany w odniesieniu do farmaceutyków.
IC50
IC50 to stężenie wymagane do wytworzenia 50% inhibicji (Rysunek 2). Wymagana ilość inhibitora zależy od różnych czynników, takich jak stężenie substratu, dostępność celu, przepuszczalność komórek, czas trwania inkubacji, rodzaj użytych komórek i inne. Coś, na co należy zwrócić uwagę, to fakt, że niższe IC50 generalnie oznacza silniejszy inhibitor, co może również oznaczać wyższą toksyczność przy niższych dawkach.
Najlepiej jest przeszukać literaturę, aby określić początkowe stężenie.
- Jeśli znane są opublikowane wartości Ki lub IC50, użyj 5 do 10 razy wyższych niż te wartości, aby maksymalnie zahamować aktywność enzymu.
- Jeśli wartości Ki lub IC50 są nieznane, należy wypróbować szeroki zakres stężeń inhibitora i zastosować kinetykę Michaelisa-Menten (więcej na ten temat poniżej) w celu określenia wartości Ki.
Nie jest niczym niezwykłym obserwowanie braku inhibicji lub nawet odwrotnego efektu, gdy stosowane są wysokie stężenia inhibitorów.

Rysunek 2.Zależność między stężeniem inhibitora a IC50.
Ki
Ki to stężenie inhibitora, przy którym obserwuje się 50% inhibicję (Ki = stała inhibicji enzymu). Cheng i Prusoff opracowali w 1973 r. równanie, które upraszcza obliczanie Ki, gdy znane jest IC50.1
Ki można obliczyć z IC50 używając równania:
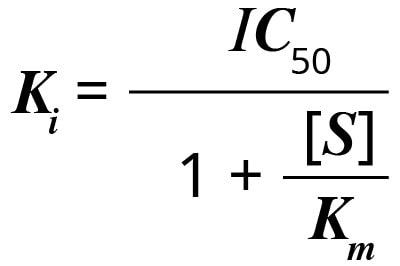
gdzie [S] to stężenie substratu, a Km to stężenie substratu (przy braku inhibitora), przy którym prędkość reakcji jest w połowie maksymalna. Ki inhibitora dla hamowania określonego substratu (stałe Km) jest stałe. Dla innego substratu, Km jest inne, podobnie jak Ki.
Kluczowe punkty:
- IC50 jest funkcjonalną siłą inhibitora i nie jest wskaźnikiem jego powinowactwa.
- Wartość IC50 dla związku może różnić się pomiędzy eksperymentami, w zależności od warunków eksperymentalnych.
- Ki odzwierciedla powinowactwo wiązania inhibitora. Jest to wartość bezwzględna.
ED50
ED50 to mediana skutecznej dawki (w przeciwieństwie do stężenia), przy której 50% osób wykazuje określony efekt ilościowy. Jest to miara rozsądnego oczekiwania efektu leku, ale niekoniecznie równa przepisanej dawce.
Kinetyka Michaelisa-Menten: Znaczenie Km i Vmax
Zrozumienie kinetyki Michaelisa-Menten jest kluczowe dla pracy z inhibitorami enzymów.
Km Kinetyka
Stała Michaelisa-Menten, Km, zdefiniowana jako stężenie substratu, przy którym obserwuje się połowę maksymalnej prędkości, różni się znacznie w zależności od enzymu. Różni się również w zależności od różnych substratów dla tego samego enzymu. Gdy stężenie substratu jest równe wartości Km, połowa miejsc aktywnych enzymu jest zajęta przez cząsteczki substratu.
Kluczowe punkty dotyczące Km:
- Km jest stałą z jednostkami M
- Km jest stałą wyprowadzoną ze stałych szybkości
- Km jest, w prawdziwych warunkach Michaelisa-Menten, oszacowaniem stałej dysocjacji enzymu i substratu
- Małe Km oznacza ścisłe wiązanie; duże Km oznacza słabe wiązanie
.W modelu Michaelisa-Menten dla kinetyki enzymów zakłada się, że enzym najpierw reaguje z substratem, tworząc kompleks enzym-substrat (ES), który rozpada się, tworząc produkt (P) i wolny enzym (E). Stąd Km można wyrazić w postaci trzech stałych szybkości (k1, k-1 i k2).
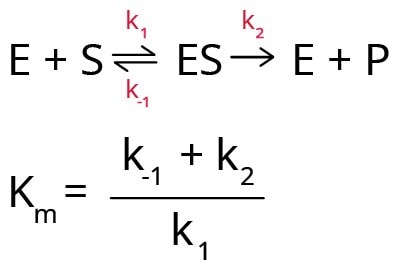
Km zależy również od temperatury, rodzaju substratu, pH środowiska reakcyjnego, siły jonowej i innych warunków reakcji. Dlatego ważne jest, aby scharakteryzować reakcje enzym-substrat w ściśle określonych warunkach. Każda zmiana wartości Km wskazuje na obecność aktywatora lub inhibitora w środowisku reakcyjnym.
Przy bardzo niskich stężeniach substratu początkowa prędkość reakcji jest proporcjonalna do stężenia substratu [S], a reakcja jest pierwszego rzędu w odniesieniu do substratu. Wraz ze wzrostem [S] początkowa szybkość reakcji spada i nie jest proporcjonalna do [S]. W tych warunkach reakcja ma charakter mieszany. Wraz z dalszym wzrostem [S], szybkość reakcji staje się niezależna od [S] i asymptotycznie zbliża się do stałej szybkości. W tym momencie reakcja jest rzędu zerowego, a enzym jest uważany za nasycony substratem. Przebieg czasowy powstawania kompleksu enzym-substrat i produktu można przedstawić tak, jak pokazano na Rysunku 3.

Rysunek 3.Czasowa zależność względnych stężeń składników reakcji enzymatycznej.
Vmax Kinetyka
Vmax, maksymalna szybkość reakcji, to szybkość, przy której całkowite stężenie enzymu jest obecne jako kompleks enzym-substrat. Vmax reprezentuje maksymalną osiągalną szybkość reakcji w danych warunkach.
Kluczowe punkty dotyczące Vmax:
- Vmax jest stałą z jednostkami s-1
- Vmax jest teoretyczną maksymalną szybkością reakcji; w rzeczywistości nigdy nie jest ona osiągana
- Osiągnięcie Vmax wymaga wszystkich cząsteczek enzymu.wymaga, aby wszystkie cząsteczki enzymu były związane z substratem
- Vmax zbliża się asymptotycznie wraz ze wzrostem [S]
Jeśli znane jest początkowe stężenie enzymu, wówczas wartość k2 można określić na podstawie Vmax. Ponieważ k2 jest stałą szybkości pierwszego rzędu, jest ona wyrażana na jednostkę czasu (na minutę lub sekundę). Znana jest również jako liczba rotacji lub stała katalityczna, kcat. Liczba rotacji to liczba cząsteczek substratu, które można przekształcić w produkt w danym okresie czasu w warunkach, w których enzym jest całkowicie nasycony substratem.
Liczbę rotacji można łatwo oszacować, mierząc szybkość reakcji w warunkach nasycenia substratem (gdzie [S] jest większe niż Km). Ogólnie rzecz biorąc, w warunkach fizjologicznych [S]/Km jest mniejsze niż 1. Jeśli [S] jest większe niż Km, wówczas prędkość początkową (V0) reakcji można zapisać następująco:
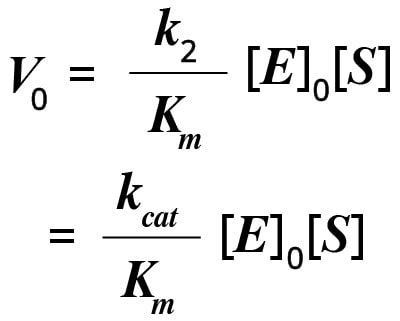
W równaniu tym, kcat/Km jest miarą wydajności katalitycznej, z większą wartością odpowiadającą tworzeniu większej ilości produktu.
Inhibicja nieodwracalna i allosteryczna
Kinetyka Michaelisa-Mentena nie może być stosowana do inhibicji nieodwracalnej, ponieważ inhibitor tworzy silne wiązanie kowalencyjne z enzymem i nie może być usunięty. W związku z tym skuteczność nieodwracalnego inhibitora zależy od szybkości, z jaką zachodzi to wiązanie. Bardzo powszechnym przykładem nieodwracalnej inhibicji jest reakcja diizopropylofluorofosforanu (DFP) z acetylocholinoesterazą (AChE). DFP tworzy wiązanie kowalencyjne z grupą hydroksylową reszty serynowej w miejscu aktywnym AChE. Utworzony kompleks jest tak stabilny, że normalne funkcjonowanie nerwów zostaje przywrócone dopiero po zsyntetyzowaniu nowego enzymu.
Allosterycznie regulowane enzymy również nie pasują do równań Michaelisa-Menten. Tutaj zamiast hiperbolicznej krzywej reakcji uzyskuje się krzywą sigmoidalną. Enzymy te posiadają wiele miejsc wiązania, a ich aktywność jest regulowana przez wiązanie inhibitorów lub aktywatorów.
Jak określić Km i Vmax<Km i Vmax można określić eksperymentalnie poprzez inkubację enzymu z różnymi stężeniami substratu. Wyniki można wykreślić jako wykres prędkości lub szybkości reakcji (V) względem stężenia substratu [S]. Spowoduje to powstanie krzywej hiperbolicznej. Prędkość reakcji i Km mają następującą zależność.
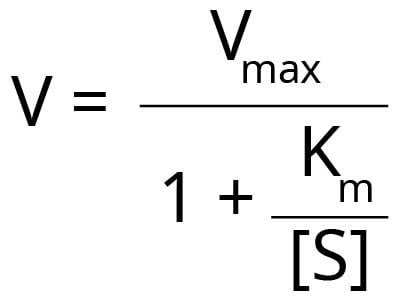
Nawet w rękach eksperta trudno jest dopasować najlepszą hiperbolę do wszystkich punktów doświadczalnych, aby dokładnie określić Vmax. Naukowcy opracowali metody zmiany układu równania Michaelisa-Menten, aby umożliwić bardziej precyzyjne dopasowanie do punktów doświadczalnych i oszacowanie Vmax i Km. Jednak każda metoda ma pewne zalety i wady.
Wykres Lineweavera-Burka
Podwójny wykres wzajemny Lineweavera-Burka (Rysunek 4) jest jedną z najpopularniejszych metod, która przekształca równanie Michaelisa-Mentena w następujący sposób:
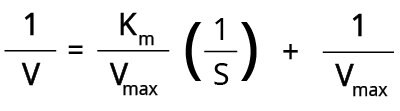
Kiedy wykreślimy 1/V względem 1/[S], otrzymamy linię prostą, gdzie:
- Intercept Y = 1/Vmax
- Gradient/Slope = Km/Vmax
- Intercept X = -1/Km
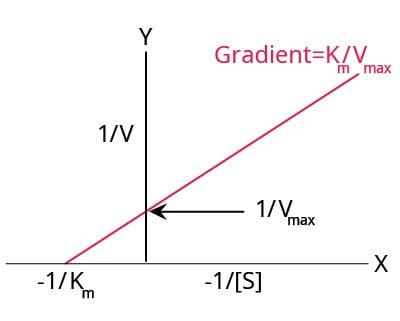
Rysunek 4.Typowy wykres Lineweavera-Burka.
Wykresy Lineweavera-Burka są najczęściej stosowanymi wykresami do linearyzacji danych i dają najdokładniejsze oszacowania Km i Vmax. Jednak metoda ta przypisuje nadmierną wagę punktom uzyskanym przy niższych stężeniach substratu, tj,
Wykres Eadie-Hofstee
Inną metodą graficznego przedstawienia kinetyki enzymatycznej jest wykres Eadie-Hofstee (Rys. 5), w którym szybkość reakcji jest wykreślana jako funkcja stosunku szybkości reakcji do stężenia substratu.
Wykres ten przekształca równanie Michaelisa-Menten w następujący sposób:
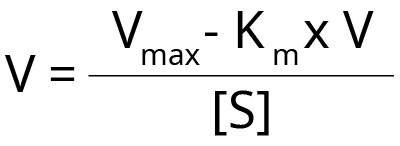
Gdy wykreślimy szybkość reakcji V względem V/[S], otrzymamy linię prostą, gdzie:
- Intercept Y = Vmax
- Gradient/Slope = -Km
- Intercept X = Vmax/ Km
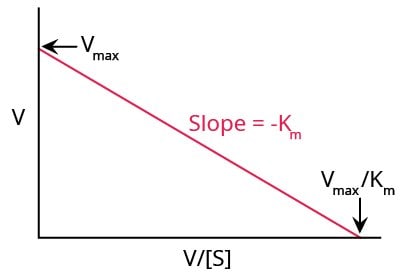
Rysunek 5.Typowa fabuła Eadie-Hofstee.
W przeciwieństwie do wykresu Lineweavera-Burka, metoda ta nadaje równą wagę wszystkim punktom danych w dowolnym zakresie stężenia substratu. Wadą tej metody jest to, że osie X i Y nie reprezentują niezależnych zmiennych i obie są zależne od szybkości reakcji. Każdy błąd eksperymentalny lub błąd przyrządu wpłynie w większym stopniu na obie osie.
Obliczanie wydajności katalitycznej w celu porównania enzymów
Gdy porównujemy szybkość reakcji różnych enzymów działających na substrat lub tego samego enzymu działającego na różne substraty, obliczenie względnej wydajności katalitycznej może poinformować nas, który enzym najlepiej nadaje się do danego substratu (substratów) w danych warunkach.
Jeśli enzym działa w warunkach stanu ustalonego, wówczas parametrami kinetycznymi tego enzymu do rozważenia są kcat (stała katalityczna konwersji substratu do produktu) i Km (stała Michaelisa-Menten). Tutaj kcat jest liczbą obrotową, która wskazuje, ile substratu jest przekształcane w produkt w określonym czasie. Stosunek kcat/Km jest równy wydajności katalitycznej, która jest następnie wykorzystywana do porównywania enzymów. Ta miara wydajności pomaga określić, czy szybkość jest ograniczona przez tworzenie produktu lub ilość substratu w mieszaninie reakcyjnej. Ogólnie rzecz biorąc, górna granica kcat/Km jest określana przez szybkość dyfuzji substratu do miejsca aktywnego enzymu.
W pewnych warunkach enzym może działać na dwa nieco powiązane substraty. W tym przypadku należy wziąć pod uwagę względne szybkości reakcji z każdym substratem, ponieważ każdy substrat ma swoją własną wartość Km. Jeśli jednak Km jest jedynym wyznacznikiem specyficzności enzymu, to wraz ze wzrostem stosunku [S]/Km powyżej 1, kcat staje się najlepszym parametrem do określenia, który substrat jest lepszy. W przypadku dwóch substratów (x i y), na które jednocześnie działa ten sam enzym, można utworzyć następujące równanie dla względnych prędkości reakcji.
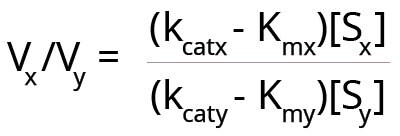
Tutaj Vx i Vy są prędkościami reakcji enzymu z substratami x i y. Stężenia substratów obu substratów to [Sx] i [Sy].
Znalezienie odpowiednich równań do swoich badań jest niezbędne do osiągnięcia sukcesu eksperymentalnego. Rozpocznij swój kolejny eksperyment już dziś, przeszukując nasze narzędzie wyszukiwania bioaktywnych małych cząsteczek, aby znaleźć wysokiej jakości sondy do swoich badań.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?