Barwienie na obecność grzybów
Vinnie Della Speranza, MS, HTL(ASCP)1, Rena Fail, HT(ASCP)1
1 Medical University of South Carolina, Charleston, SC
Ten artykuł został przedrukowany za zgodą z HistoLogic, vol. 38 nr 1, 2005.
.Importance of Fungal Stains
Barwniki grzybicze pozostają ważnym narzędziem w arsenale diagnostycznym laboratorium histologicznego do identyfikacji mikroorganizmów zakaźnych. Grzybice skóry lub powierzchowne infekcje grzybicze skóry rzadko stanowią poważny problem zdrowotny u ludzi, jednak grzybice ogólnoustrojowe z takimi organizmami jak Cryptococcus neoformans i Candida albicans mogą powodować zagrażające życiu infekcje, szczególnie u osób z obniżoną odpornością. W związku z tym barwienia grzybicze są często zlecane w trybie pilnym przez patologa chirurgicznego, gdy w barwieniu H&E obserwuje się oznaki zakażenia grzybiczego.
Odczynnik Schiffa i roztwory srebra heksaminy
Większość grzybów jest dość duża, a ich ściany są bogate w polisacharydy (grupy 1,2-glikolowe), co można wykazać za pomocą odczynnika Schiffa lub roztworów srebra heksaminy (metenaminy).1 Obie techniki opierają się na użyciu utleniacza (kwasu okresowego lub kwasu chromowego) w celu utworzenia miejsc wiązania aldehydów dla jonów Schiffa lub srebra.Barwienie srebrem Grocotta (GMS) jest prawdopodobnie najczęściej stosowanym barwieniem grzybów, jednak nieco kapryśna natura barwienia srebrem może stanowić wyzwanie nawet dla najbardziej doświadczonych histologów. Niewystarczająca impregnacja srebrem, nadmierne barwienie, które powoduje wysokie zabarwienie tła lub niepożądany osad mogą przyczynić się do trudności w znalezieniu zabarwionych organizmów grzybowych. Właściwe określenie punktu końcowego barwienia za pomocą mikroskopu w wielu przypadkach ma zasadnicze znaczenie dla pomyślnego wyniku.
W rezultacie niektórzy patolodzy rutynowo zamawiają okresowe barwienie kwasem Schiffa (PAS) w nadziei na uzyskanie szybkiego i bardziej niezawodnego barwienia. Metoda ta jest jedną z najczęściej stosowanych technik w laboratoriach histologicznych. Jest stosunkowo prosta do wykonania i niezawodna, nawet w niedoświadczonych rękach. Barwienie PAS niezawodnie wykazuje polisacharydową ścianę większości organizmów grzybiczych, z wyjątkiem Histoplasma capsulatum.2
.Niezamierzone barwienie składników polisacharydowych
Jedną z wad stosowania PAS do barwienia grzybów jest jednak to, że barwi ona polisacharydy wszędzie tam, gdzie pojawiają się one w tkankach. Metoda ta barwi wiele składników wewnątrzkomórkowych w różnych typach normalnych komórek, pochodzących od wielu różnych gatunków zwierząt. Niektóre z tych składników wewnątrzkomórkowych są wymienione poniżej3:
- glikogen
- neutralne substancje śluzowe
- niektóre nabłonkowe sulfomucyny i sialomucyny
- koloid tarczycy
- błony podstawne/li>
- włókna siatkowate
- ziarnistości komórek okładzinowych
- komórki chromafinowe nadnerczy
- glikolipidy neuronalne
- wtrącenia bezjądrowe w nasieniowodach
- komórki fibrylarne tętniczek nerkowych
- granulki w komórkach siateczkowo-śródbłonkowych
- gruczoły ślinowe
- gruczoły żołądkowe i gruczoły Brunnera
- mucyna z dróg oddechowych
- gruczoły acinarne i endokrynne, w tym prostata u mężczyzn
Zawartość tych elementów w niektórych tkankach może rozpraszać uwagę podczas próby znalezienia organizmów grzybiczych barwionych PAS. W rezultacie patolodzy, którzy wykorzystują PAS do barwienia grzybów, często proszą o barwienie z trawieniem diastazą, próbując zminimalizować barwienie struktur mało interesujących lub nieinteresujących.
Oxidizing Agents in Stains
Co ciekawe, niewielu histologów kwestionuje użycie utleniacza kwasu okresowego w barwieniu PAS, a jednak używamy utleniacza kwasu chromowego w barwieniu GMS dla grzybów. W rzeczywistości, jeśli mielibyśmy zastąpić kwas okresowy kwasem chromowym w barwieniu GMS, zasadniczo wykonalibyśmy metodę Jonesa, która specyficznie barwi błony podstawne i włókna siatkowate.
Tak, technika Jonesa może wykazać grzyby; jednak zabarwi również wiele innych struktur, co znacznie utrudni odkrycie organizmów grzybowych. Niezależnie od tego, czy używamy barwnika Schiffa czy srebra, słabszy utleniacz kwasu okresowego tworzy miejsca wiązania aldehydów w wielu innych strukturach tkankowych. W tym przykładzie widzimy, jak wybór środka utleniającego może znacząco określić, które struktury zostaną zabarwione. Wybór ten zmaksymalizuje prawdopodobieństwo osiągnięcia pożądanych wyników.
Obserwacje te były w rzeczywistości dość dobrze znane pokolenie lub dwa temu. Jednak te starsze, ale wciąż ważne informacje mogą być czasami pomijane. Współcześni histolodzy mogą dziś wykorzystać te informacje, aby poprowadzić patologów chirurgicznych w wyborze najbardziej odpowiedniej dostępnej metody barwienia.
Bauerowi (1933) przypisuje się najwcześniejsze doniesienie, że utlenianie cukrów (1,2-glikoli) kwasem chromowym tworzy aldehydy, które wiążą cząsteczkę Schiffa.4 Wielu innych, w tym Hotchkiss, McManus (1960), Spicer, Pearse i Lillie kontynuowało badania reakcji aldehyd-Schiff przy użyciu różnych utleniaczy. Stało się jasne, że siła utleniacza, czas ekspozycji i gęstość cukrów w interesujących strukturach tkankowych określają lokalizację, w której cząsteczka Schiffa będzie się wiązać.
Zarówno kwas chromowy, jak i nadmanganian potasu, które są silniejszymi utleniaczami niż kwas okresowy, również wytwarzają aldehydy w polisacharydach, ale dalej atakują i niszczą te aldehydy, jeśli mają wystarczająco dużo czasu. Ze względu na dalsze utlenianie aldehydu przez kwas chromowy, osiąga się mniejszą gęstość reakcji aldehydowej i nie wykazuje się struktur z mniejszą liczbą grup glikolowych, takich jak błony podstawne oraz włókna kolagenowe i siatkowe."5 To stwierdzenie Lillie mówi nam, dlaczego kwas chromowy jest lepszym utleniaczem podczas barwienia grzybów, ponieważ organizmy te mają większą gęstość cukru (polisacharydów) w ścianie komórkowej.
Podczas gdy kwas chromowy kontynuuje dalsze utlenianie wszystkich polisacharydów, całkowita konwersja w obszarach o największym stężeniu trwa dłużej, pozwalając im pozostać reaktywnymi z Schiffem (lub srebrem).2 Ponieważ ściany grzybów są szczególnie bogate w grupy 1,2-glikolowe, barwią się one intensywniej niż większość innych reaktywnych składników w przekroju tkanki. Kontrast między grzybami i tłem jest często bardziej wyraźny niż to, co widać w zduplikowanych sekcjach wybarwionych reakcją PAS3 (Figures 1 i 2). Ta dyskusja sugeruje, że jeśli grzyby są obecne w wycinku tkanki, jest mniej prawdopodobne, że zostaną pominięte, gdy użyty zostanie silniejszy utleniacz, taki jak kwas chromowy.
Recommendation: Kwas chromowy, a następnie Schiff
Praca w naszym laboratorium przekonała nas, że użycie kwasu chromowego jako utleniacza, a następnie Schiffa, daje lepsze wyniki niż PAS do barwienia grzybów, ponieważ barwienie tła jest znacznie zmniejszone. Podejście to jest tak proste, jak wykonanie typowego PAS, ale pozwala uniknąć konieczności trawienia diastazą, co dodaje niepotrzebnej pracy i kosztów do barwienia grzybów. Metoda opisana przez Casella3 wykorzystująca nadmanganian potasu jako utleniacz jest kolejną odpowiednią alternatywą dla kwasu okresowego i daje podobne wyniki do kwasu chromowego podczas barwienia grzybów.
Co ciekawe, kwas chromowy-Schiffa (CAS) jest niezwykle podobny do metody Gridleya6 którą można znaleźć w wielu tekstach histologicznych, z wyjątkiem tego, że technika Gridleya wymaga również użycia aldehydu fuksyny po Schiffie. Odbywa się to w celu uzyskania bardziej intensywnego barwienia.7 Fuksyna aldehydowa działa jak aldehyd i zajmuje niezaangażowane wiązania odczynnika Schiffa, wzmacniając w ten sposób głębokość barwienia.2 Chociaż potwierdziliśmy, że fuksyna aldehydowa faktycznie intensyfikuje zabarwione organizmy, spekulujemy, że metoda Gridleya nie jest obecnie powszechnie stosowana, ponieważ barwienie fuksyną aldehydową wymaga użycia paraldehydu, substancji kontrolowanej, której uzyskanie może być problematyczne w niektórych laboratoriach.
Podsumowując, następnym razem, gdy patolog poprosi o PAS dla grzybów, zalecamy zasugerowanie CAS jako znacznie lepszej alternatywy. Nie ma sensu używać utleniacza, który wytworzy aldehydy w niepożądanych miejscach tylko po to, aby później użyć enzymu do ich wyeliminowania. Lepiej unikać ich tworzenia w pierwszej kolejności. Prosta demonstracja z równolegle zabarwionymi sekcjami, jedna zabarwiona PAS, a druga CAS, przekona nawet najbardziej sceptycznego obserwatora.

Rysunek 1. Pozytywna kontrola grzybów. Barwienie PAS, 400x
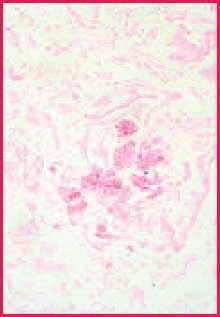
Rysunek 2. Pozytywna kontrola grzybów. Barwienie kwasem chromowym-Schiff, 400x
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?