N-Heterocykliczne karbeny (NHC) Ligandy & Zestaw do transformacji organicznych
Szybki postęp w reakcjach sprzęgania krzyżowego nieaktywowanych substratów katalizowanych przez kompleksy metali przekształcił rynek chemiczny poprzez wprowadzenie obszernej biblioteki achiralnych i chiralnych ligandów fosfinowych. Pozytywny wpływ ligandów fosfinowych został zilustrowany w licznych doniesieniach o wysoce wydajnych systemach pod względem obrotów i selektywności stosowanych w tradycyjnych procesach przemysłowych, takich jak uwodornienie. Jednak wady związane z wysokimi kosztami produkcji trzeciorzędowych (zwłaszcza chiralnych) fosfin i ich degradacyjną tendencją do przekształcania się w tlenki fosfiny zostały dopiero teraz rozwiązane przez bogatą dziedzinę ligandów NHC wykorzystywanych w katalizie homogenicznej.1
Zalety N-heterocyklicznych karbenów jako ligandów pomocniczych są następujące:
- są silniejszymi s-donorami niż fosfiny, umożliwiając korzystne szybkości katalizowanej palladem utleniającej addycji chlorków arylowych;
- silne wiązanie metal-karben kompleksu NHC sprzyja ścisłej kinetyce wiązania, zmniejszając tym samym dysocjację ligandu;
- obecność sterycznie obciążających grup związanych z atomami N ułatwia redukcyjną eliminację produktu z palladu; oraz
- aktywność ligandów NHC może być modyfikowana przez zdalne wprowadzenie elektronowych podstawników kierujących, co zaobserwowano w syntezie benzimidazolidyn, które zawierają elektronowo odmienne grupy na szkielecie aromatycznym.2
Dostępna jest obecnie szeroka gama ligandów NHC, które wykazują wysoką aktywność w różnych ważnych transformacjach organicznych w połączeniu z metalowymi katalizatorami wstępnymi. Ligandy imidazolidynowe NHC ze sterycznie obciążającymi grupami, takimi jak mesityl, izopropyl i adamantyl, zostały wykorzystane w katalizowanej Pd cyklizacji anilidów,3 aminowaniu chlorków arylu,4 arylowanie enolanami estrów w celu otrzymania estrów a-arylowych,5 reakcje Sonogashiry nieaktywowanych bromków alkilowych,6 oraz katalizowaną rutenem reakcję RCM (Schematy 1-5).7 Ten ostatni przykład pokazuje moc ligandów NHC do stabilizacji metalu aktywnego w roztworze, a tym samym nadaje katalizatorowi zdolność do wywoływania RCM na wysoce podstawionych i ubogich w elektrony olefinowych reagentach, dając tetrasubstytuowane produkty. Taka wyraźna reaktywność była wyłączną domeną katalizatorów alkilidenowych Shrocka.8 Jednak zastosowanie tych imidazolidyn prowadzi do poprawy wydajności w porównaniu z wczesnymi katalizatorami metatezy rutenu i zapewnia dodatkowe cechy stabilności w porównaniu z systemem Shrocka. Naszym celem w Sigma-Aldrich jest przyspieszenie nowatorskich projektów badawczych w dziedzinie chemii z udziałem ligandów NHC. W tym celu jako pierwsi oferujemy zestaw ligandów składający się z różnorodnego zestawu sterycznie wymagających ligandów NHC.

Schemat 1.

Schemat 2.
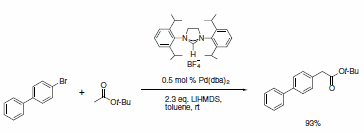
Schemat 3.
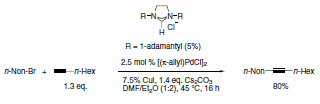
Schemat 4.
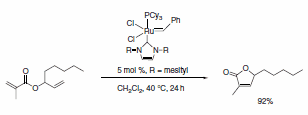
Schemat 5.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?