Kriokonserwowane PBMC zachowują fenotyp i funkcję
Zamrożone (kriokonserwowane) jednojądrzaste komórki krwi obwodowej (PBMC) oferują wiele korzyści w porównaniu ze świeżymi PBMC, umożliwiając badaczom planowanie eksperymentów z wyprzedzeniem dzięki gotowym do użycia komórkom, które można przechowywać w zamrażarce do czasu ich użycia. Jedną z obaw związanych z zamrożonymi komórkami jest potencjalna utrata żywotności, fenotypu lub funkcji wynikająca z kriokonserwacji. Przedstawiamy charakterystykę zamrożonych PBMC z BioIVT, a także bezpośrednie porównanie odpowiedzi aktywacji komórek T poprzez pomiar poziomów ekspresji dobrze znanych markerów aktywacji komórek T (CD25 i CD69). Dane sugerują, że zamrożone PBMC zachowały żywotność i fenotyp podczas kriokonserwacji. Mimo zahamowania wzrostu, limfocyty T wykazywały odpowiednią odpowiedź aktywacyjną po stymulacji przeciwciałami anty-CD3 i anty-CD28. Funkcjonalne, żywotne PBMC poddane kriokonserwacji stanowią wygodną alternatywę dla świeżych PBMC w testach komórkowych i badaniach immunologicznych.
Charakterystyka zamrożonych PBMC
Zamrożone PBMC zostały najpierw ocenione pod kątem żywotności przy użyciu barwienia jodkiem propidyny i scharakteryzowane za pomocą cytometrii przepływowej przy użyciu przeciwciał fluorescencyjnych przeciwko następującym markerom białkowym:
- CD14 (marker monocytów)
- CD56 (marker komórek NK)
- CD4 (podzbiór limfocytów T pomocniczych)
- CD8 (podzbiór limfocytów T)
- CD19 (limfocyty B)
Do wszystkich eksperymentów użyto kriokonserwowanych PBMC od trzech indywidualnych zdrowych dawców. Reprezentatywne dane przedstawiono na Rysunku 1. Wyniki dotyczące żywotności i składu podsumowano w Tabeli 1. Średnia żywotność komórek została określona na 91,8% (Rysunek 1.A.). Skład fenotypowy każdej populacji komórek, wyrażony jako procent populacji komórek bramkowanych (patrz Rysunek 1.B.), był zgodny z oczekiwanymi wartościami. Wyniki sugerują, że zamrożone PBMC zachowały żywotność i fenotyp podczas kriokonserwacji i rozmrażania.
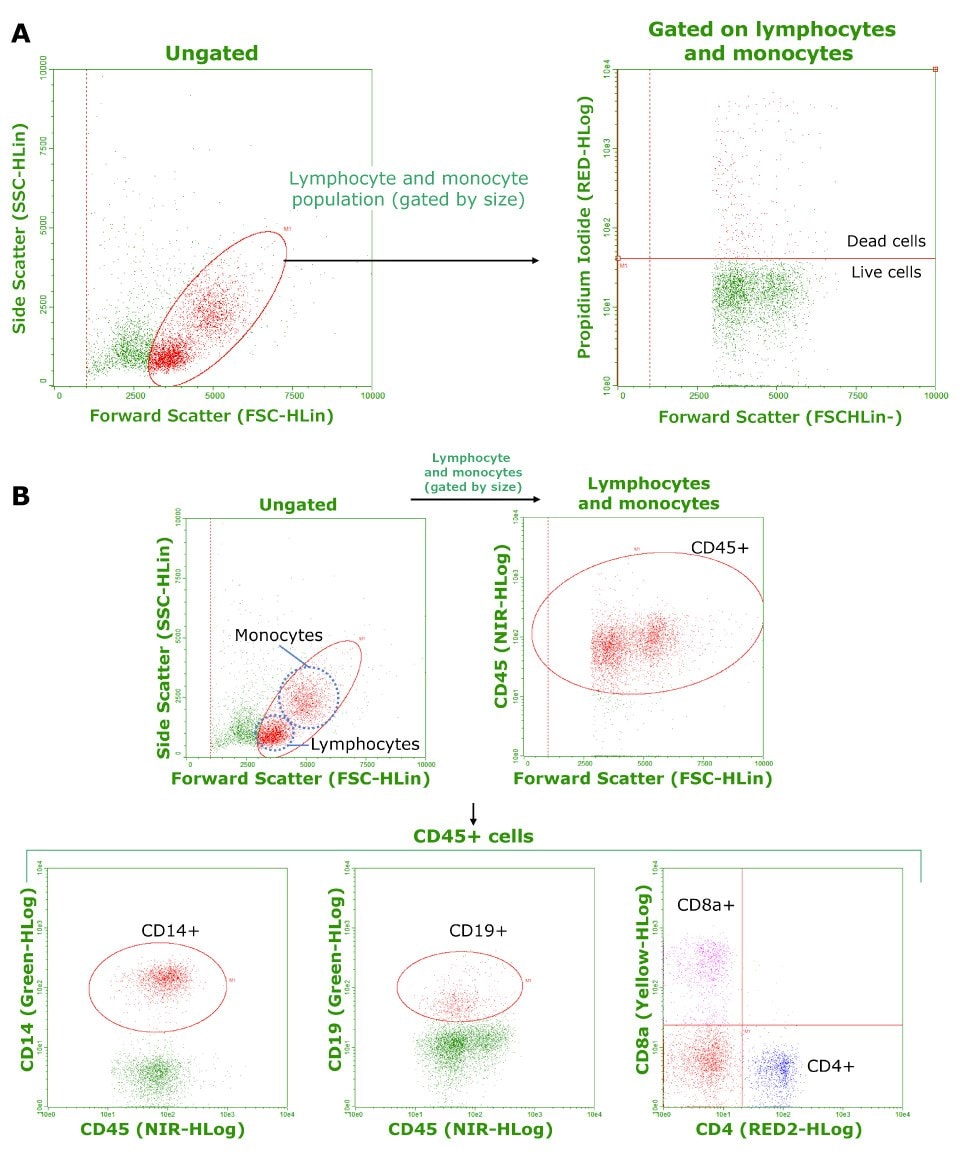
Rysunek 1.A) Żywotność zamrożonych PBMC określona za pomocą barwienia jodkiem propidyny i cytometrii przepływowej. Obliczona żywotność komórek (uśredniona z trzech próbek) wyniosła 91,8%. B) Analiza fenotypowa zamrożonych PBMC. Komórki CD45+ analizowano pod kątem ekspresji CD14, CD19 i CD8/CD4 w celu określenia składu odpowiednio monocytów, komórek B i komórek T. W przypadku komórek NK zastosowano barwienie CD56. Tabelaryczne wyniki przedstawiono w Tabeli 1.
PBMC i aktywacja komórek T
Komórki jednojądrzaste krwi obwodowej składają się z limfocytów (komórek T, komórek B, komórek NK) i monocytów. Komórki te dają selektywne odpowiedzi układowi odpornościowemu i są kluczowymi graczami w odporności. Komórki T są aktywowane przez sygnały zewnątrzkomórkowe, w których pośredniczą głównie kompleksy receptorów komórek T (TCR). Wykazano, że niektórzy agoniści, tacy jak przeciwciała przeciwko CD3 i CD28, mogą wyzwalać sygnalizację TCR obserwowaną poprzez zmiany w ekspresji markerów powierzchniowych komórek, podobne do rzeczywistej aktywacji TCR poprzez stymulację antygenową. Aktywacja komórek T skutkuje zwiększoną ekspresją CD25 i przejściowo zwiększoną ekspresją CD69 (Rysunek 2). Markery powierzchniowe komórek CD25 i CD69 mogą być zatem stosowane jako mierniki aktywacji i funkcji komórek T.

Rysunek 2.Aktywowane limfocyty T wykazują zwiększoną ekspresję CD25 i przejściowo zwiększoną ekspresję CD69.
Aby ustalić, czy te zamrożone PBMC zachowały swoją funkcję, użyliśmy cytometrii przepływowej do pomiaru zmian CD25 i CD69 po stymulacji przeciwciałami anty-CD3 i anty-CD28. Eksperymenty przeprowadzono przy użyciu zarówno świeżych, jak i zamrożonych PBMC.
Ekspresja CD25
Próbki PBMC były przetwarzane w trzech oddzielnych eksperymentach. W każdym eksperymencie porównywano ekspresję markerów powierzchniowych komórek przy użyciu dwóch próbek świeżych komórek od różnych dawców i dwóch próbek zamrożonych komórek od różnych dawców. Komórki aktywowano przy użyciu pożywki RPMI(+) zawierającej przeciwciała anty-CD3 (3 µg/ml) i anty-CD28 (1 µg/ml). Pożywka RPMI(+) bez przeciwciał aktywujących została użyta jako kontrola podstawowa. Komórki barwiono przy użyciu fluorescencyjnie znakowanego przeciwciała anty-CD25 we wskazanych punktach czasowych po aktywacji i analizowano tego samego dnia za pomocą cytometrii przepływowej (Rysunek 3). Do analizy komórki były bramkowane według wielkości populacji limfocytów przy użyciu obszaru rozproszenia do przodu i obszaru rozproszenia bocznego. Komórki zostały następnie wybrane przez bramkowanie limfocytów przy użyciu ekspresji CD45+ i bramkowanie komórek T przy użyciu połączonej bramki CD4+ i/lub CD8+. Zgodnie z oczekiwaniami, zarówno świeże, jak i mrożone PBMC wykazywały wzrost ekspresji CD25 komórek T po aktywacji przeciwciałami anty-CD3 i anty-CD28. Świeże komórki wykazywały większy początkowy wzrost ekspresji CD25 w porównaniu do zamrożonych komórek po aktywacji, chociaż silną odpowiedź nadal obserwowano w przypadku zamrożonych komórek w dniach 1 i 3. Dłuższe inkubacje spowodowały większy wzrost ekspresji CD25 zarówno dla świeżych, jak i mrożonych komórek.
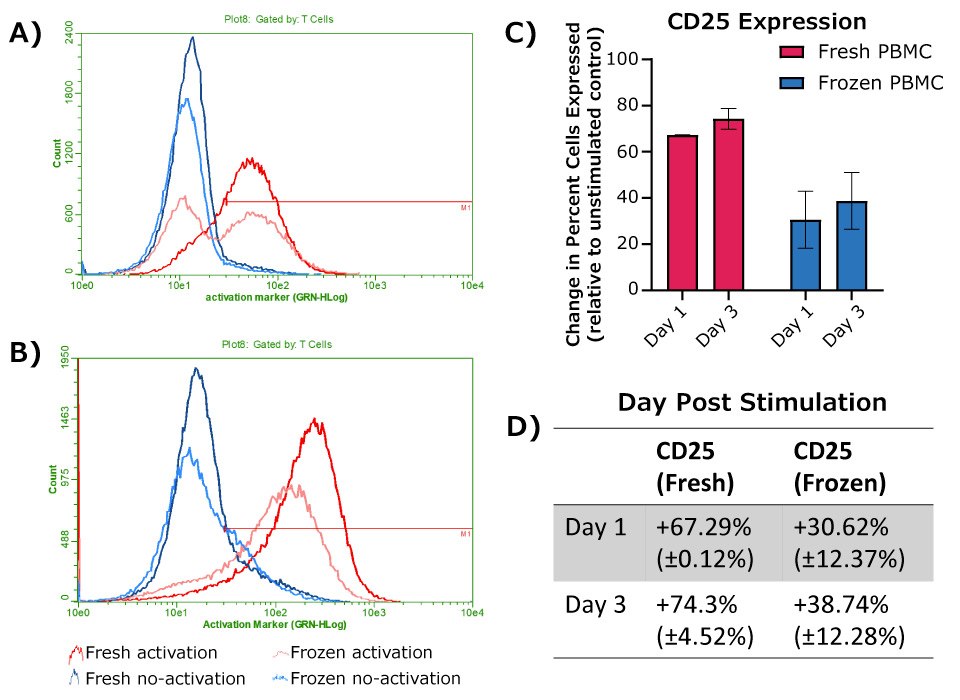
Rysunek 3.Ekspresja CD25 po 24 godzinach (A) lub 72 godzinach (B) po aktywacji, z próbkami kontrolnymi dopasowanymi do dawcy bez aktywacji dla każdego punktu czasowego. A-B) Reprezentatywne histogramy, z pokazanymi komórkami bramkowanymi na CD45+ WBC i CD4+ lub CD8+ dla limfocytów T. C) Zmiana procentu populacji komórek wyrażających CD25, obliczona jako różnica między próbkami aktywacji dopasowanymi do dawcy i próbkami bez aktywacji (świeże PBMC, n = 2; zamrożone PBMC, n = 4). D) Tabela przedstawiająca wartości przedstawione w C.
Ekspresja CD69
Eksperymenty i strategię bramkowania przeprowadzono tak, jak opisano dla CD25, stosując fluorescencyjnie znakowane przeciwciało anty-CD69 zamiast fluorescencyjnego przeciwciała anty-CD25. Wyniki przedstawiono na Rysunku 4. Zgodnie z oczekiwaniami, zarówno świeże, jak i mrożone PBMC wykazywały wzrost ekspresji CD69 komórek T po aktywacji przeciwciałami anty-CD3 i anty-CD28. Świeże komórki ponownie wykazywały większy początkowy wzrost ekspresji CD69 w porównaniu do zamrożonych komórek po aktywacji, chociaż wykrywalna odpowiedź była nadal obserwowana w przypadku zamrożonych PBMC. W przypadku CD69 znacznie większą odpowiedź zaobserwowano jeden dzień po aktywacji w porównaniu do trzech dni po aktywacji zarówno dla świeżych, jak i zamrożonych komórek. Jest to zgodne z oczekiwaną przejściową odpowiedzią markera powierzchni komórki CD69.

Rysunek 4.Ekspresja CD69 po 24 godzinach (A) lub 72 godzinach (B) po aktywacji, z próbkami kontrolnymi dopasowanymi do dawcy bez aktywacji dla każdego punktu czasowego. A-B) Reprezentatywne histogramy, z pokazanymi komórkami bramkowanymi na CD45+ WBC i CD4+ lub CD8+ dla komórek T. C) Zmiana procentu populacji komórek wyrażających CD69, obliczona jako różnica między próbkami aktywowanymi i nieaktywowanymi (świeże PBMC, n = 2; zamrożone PBMC, n = 4). D) Tabela przedstawiająca wartości przedstawione w C.
Podsumowanie funkcji mrożonych PBMC
Wyniki funkcjonalne podsumowano na Rysunku 5. Wzorce zmian w ekspresji markerów CD25 i CD69 odpowiadały oczekiwanym odpowiedziom zarówno dla świeżych, jak i mrożonych próbek PBMC. Mrożone PBMC wykazywały słabszą początkową aktywację w porównaniu do świeżych PBMC, mierzoną zmianami w ekspresji markerów CD25 i CD69. Pomimo tej różnicy, wykrywalne odpowiedzi zaobserwowano w przypadku zamrożonych komórek zarówno 24 godziny, jak i 72 godziny po aktywacji. Dane te sugerują, że zamrożone PBMC zachowują żywotność, fenotyp i funkcję po kriokonserwacji, oferując wygodną, gotową do użycia alternatywę dla świeżych komórek do większości zastosowań.

Rysunek 5.Podsumowanie danych porównujących aktywację świeżych i mrożonych PBMC mierzoną zmianami ekspresji markerów CD25 i CD69. Chociaż słabszą odpowiedź zaobserwowano w przypadku zamrożonych komórek, dane sugerują, że te kriokonserwowane PBMC zachowują swoją funkcję.
Materiały
Rozmrażanie i obróbka komórek
- Odmrażać zamrożone fiolki PBMC w łaźni wodnej o temperaturze 37°C przez 2-5 minut.
- Dodać pożywkę RPMI(+) zarówno do zamrożonych, jak i świeżych PBMC.
- Odwirowywać komórki z prędkością 300 x g przez 5 minut.
- Usuń supernatant.
- Zawieś ponownie komórki w pożywce RPMI(+).
- Zlicz komórki na hemocytometrze i umieść 100 000 żywych komórek w objętości 200 µl na studzienkę na 96-dołkowej płytce. Należy pamiętać, że próbki zostaną ponownie zawieszone w pożywce RPMI(+) zawierającej anty-CD3 (końcowe stężenie 3 µg/ml) i anty-CD28 (końcowe stężenie 1 µg/ml) w przypadku stymulacji i odpowiedzi aktywacyjnej lub tylko w pożywce RPMI(+) w przypadku próbek nieaktywowanych.
Barwienie komórek i bramkowanie na cytometrze przepływowym
- Do wszystkich etapów płukania użyj buforu FACS.
- Zacznij od próbek na 96-dołkowej płytce, jak opisano w sekcji "Rozmrażanie i obróbka komórek". Przenieś całą objętość każdej studzienki (~200 µl) do poszczególnych probówek mikrowirówkowych.
- Dodaj 1 ml buforu FACS do każdej probówki mikrowirówkowej.
- Odwiruj probówki mikrowirówkowe w wirówce z prędkością 300 x g przez 5 minut. Upewnij się, że komórki tworzą osad. Jeśli nie ma widocznego osadu, powtórz wirowanie komórek.
- Usuń supernatant do linii 50 µl na probówce do mikrowirówki. Ponownie zawiesić komórki za pomocą lekkiego pipetowania.
- Dodać znakowane fluorem przeciwciało przeciwko pożądanemu markerowi powierzchniowemu komórek i inkubować w ciemności przez 40 minut w temperaturze pokojowej.
- Powtórzyć kroki 3-5.
- Zawiesić ponownie komórki w 250 µl buforu FACS i wymieszać przez delikatne pipetowanie. W razie potrzeby wybarw komórki pod kątem żywotności.
- Przenieś pełną objętość (~300 µl) z każdej probówki do mikrowirówki na 96-dołkową płytkę z dnem U do analizy przy użyciu cytometru przepływowego Guava® easyCyte™ 8HT.
Zobacz naszą pełną listę normalnych PBMC, PBMC w stanie chorobowym i podgrup komórek odpornościowych od BioIVT.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?