Oczyszczanie przy użyciu kolumn MBPTrap™ HP
Kolumny MBPTrap HP 1 mL i 5 mL (Rysunek 6.2) są wykonane z biokompatybilnego polipropylenu, który nie wchodzi w interakcje z biomolekułami. Wstępnie zapakowane kolumny MBPTrap HP zapewniają szybką, prostą i łatwą separację w wygodnym formacie. Mogą być obsługiwane za pomocą strzykawki, pompy laboratoryjnej lub systemu chromatografii cieczowej, takiego jak ÄKTA.
Kolumny MBPTrap HP są dostarczane z zatyczką na wlocie i zatrzaskową końcówką na wylocie. Porowate górne i dolne fryty umożliwiają wysokie szybkości przepływu. Kolumny MBPTrap HP należą do rodziny kolumn pakowanych HiTrap. Należy pamiętać, że kolumn HiTrap nie można otwierać ani ponownie napełniać.
Tabela A3.2 (Dodatek 3, Charakterystyka wysokowydajnych produktów z sefarozy dekstrynowej) podsumowuje charakterystykę wstępnie zapakowanych kolumn MBPTrap HP.
Rysunek 6.2.Kolumny MBPTrap HP 1 mL i 5 mL zapewniają szybkie i wygodne oczyszczanie rekombinowanych białek znakowanych MBP.
Przygotowanie próbki
Dostosuj próbkę do składu buforu wiążącego (patrz poniżej). Na przykład rozcieńczyć próbkę buforem wiążącym lub wymienić bufor przy użyciu kolumny odsalającej (Rozdział 11, Desalting/buffer exchange and concentration).
Przepuścić próbkę przez filtr 0,22 µm lub 0,45 µM i/lub odwirować ją bezpośrednio przed nałożeniem na kolumnę. Jeśli próbka jest zbyt lepka, aby zapobiec zatkaniu kolumny, należy rozcieńczyć ją buforem wiążącym, zwiększyć obróbkę lizy (sonikacja, homogenizacja) lub dodać DNazę/RNazę w celu zmniejszenia wielkości fragmentów kwasu nukleinowego.
Woda i chemikalia używane do przygotowania buforów powinny być wysokiej czystości. Przed użyciem należy przefiltrować bufory przez filtr 0,22 µm lub 0,45 µm.
Purifikacja
Kolumny MBPTrap HP mogą być obsługiwane za pomocą strzykawki, pompy laboratoryjnej lub systemu chromatografii cieczowej, takiego jak ÄKTA.
- Napełnij strzykawkę lub rurkę pompy buforem wiążącym. Zdejmij zatyczkę i podłącz kolumnę do strzykawki (za pomocą dostarczonego złącza) lub rurki pompy "kropla do kropli", aby uniknąć wprowadzenia powietrza do kolumny.
- Usuń zatrzask na wylocie kolumny. Wypłukać etanol za pomocą co najmniej 5 objętości wody destylowanej lub buforu wiążącego.
- Wyrównać kolumnę za pomocą co najmniej 5 objętości buforu wiążącego z prędkością 1 ml/min lub 5 ml/min odpowiednio dla kolumn 1 ml i 5 ml.
- Nałożyć próbkę za pomocą strzykawki przymocowanej do złącza Luer lub pompując ją na kolumnę1.
- Płukać 5 do 10 objętościami buforu wiążącego lub do momentu, gdy w roztworze nie pojawi się żaden materiał.
- Elucja 5 objętościami buforu elucyjnego. Wymyte frakcje mogą być wymienione na bufor przy użyciu kolumny odsalającej (Rozdział 11, Desalting/wymiana buforowa i zatężanie).
- Po elucji zregeneruj kolumnę zgodnie z procedurą opisaną w Appendix 3 (Characteristics of Dextrin Sepharose High Performance products).
1 Niższa szybkość przepływu (0.5 mL/min lub 2,5 mL/min odpowiednio dla kolumn 1 mL i 5 mL) może być użyta podczas aplikacji próbki w celu optymalizacji wydajności. Korelacja między szybkością przepływu a liczbą kropli jest następująca: szybkość 0,5 ml/min odpowiada około 15 kroplom/min przy użyciu strzykawki z kolumną HiTrap 1 ml, a 2.5 mL/min odpowiada około 60 kroplom/min przy użyciu kolumny HiTrap 5 mL.
Skalowanie z 1 mL do 5 mL kolumn MBPTrap HP można łatwo wykonać, zwiększając pięciokrotnie obciążenie próbki i szybkość przepływu. Alternatywną metodą szybkiego zwiększenia skali jest połączenie dwóch lub trzech kolumn MBPTrap HP szeregowo (ciśnienie wsteczne wzrośnie). Rysunek 6.7 przedstawia przykład zwiększania skali przy użyciu tego medium.
Kolumny MBPTrap HP można łatwo czyścić za pomocą 0,5 M NaOH.
Kolumny MBPTrap HP należy przechowywać w 20% etanolu w temperaturze od 2 °C do 8 °C.
Przykłady zastosowań
1. Zautomatyzowane dwuetapowe oczyszczanie na ÄKTAxpress
MBPTrap HP 1 mL został użyty jako pierwszy etap oczyszczania w zautomatyzowanym dwuetapowym oczyszczaniu na ÄKTAxpress. Drugi etap, SEC, został przeprowadzony na HiLoad 16/60 Superdex 200 pg. MBP2*-paramyozyna-δ-Sal (Mr ~70 000), która istnieje jako multimer w roztworze, została oczyszczona z lizatu E. coli . Rysunek 6.3 przedstawia warunki pracy i wynikowy chromatogram automatycznego oczyszczania. Całkowita wydajność końcowa po dwóch etapach wyniosła 2,16 mg, a całkowity czas pracy wyniósł tylko 3,4 h. Analiza SDS-PAGE na Rysunku 6.4 pokazuje wysoką czystość połączonej frakcji z końcowego etapu SEC.

Rysunek 6.3.Zautomatyzowane oczyszczanie MBP2*-paramyozyny-δ-Sal przy użyciu dwuetapowego protokołu AC-SEC na MBPTrap HP 1 mL (AC) i HiLoad 16/60 Superdex 200 pg (SEC).

Rysunek 6.4.Analiza SDS-PAGE (warunki redukujące) oczyszczania MBP2*-paramyozyna-δ-Sal.
2. Oczyszczanie białka zaangażowanego w choroby metaboliczne
Kolumna MBPTrap HP została wykorzystana w procedurze oczyszczania średniołańcuchowej dehydrogenazy acylo-CoA (MCAD). Ten homotetramer (Mr 85 500), który jest zaangażowany w choroby metaboliczne, został oczyszczony do badań stabilności, fałdowania i kinetyki (Rys. 6.5). Oprócz AC, procedura oczyszczania obejmowała również etap SEC.
Czystość eluowanych frakcji z MBPTrap HP i SEC określono za pomocą analizy SDS-PAGE. Niektóre dodatkowe białka oprócz białka docelowego zostały wykryte po etapie oczyszczania. Może to być spowodowane obecnością skróconych wariantów, które nadal mają nienaruszony N-końcowy tag MBP, lub prawdopodobnie białek związanych z białkiem docelowym (nie było to dalej oceniane). Końcowa czystość po SEC była bardzo wysoka zgodnie z analizą SDS-PAGE (Rysunek 6.6). Końcowa wydajność wyniosła około 8,4 mg MCAD.

Rysunek 6.5.Oczyszczanie MCAD na (A) MBPTrap HP, a następnie (B) Superdex 200 pg.
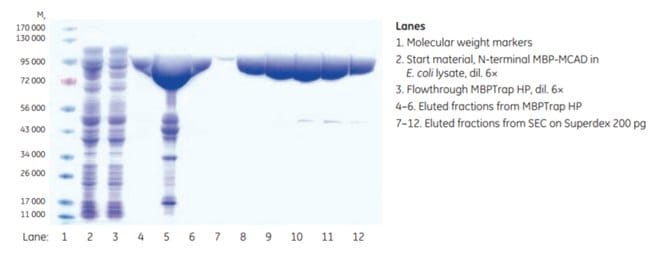
Rysunek 6.6.Analiza SDS-PAGE (warunki redukujące) frakcji z dwuetapowego oczyszczania MCAD. Dane uprzejmie dostarczone przez Dr. Esther M. Maier i Dr. von Haunersches Kinderspital, Monachium, Niemcy.
3. Zwiększanie skali
Zwiększanie skali można osiągnąć poprzez zwiększenie objętości złoża przy jednoczesnym utrzymaniu stałego czasu przebywania. Takie podejście utrzymuje wydajność chromatograficzną podczas skalowania. MBP2*-β-galaktozydaza (Mr ~158 000), multimer znakowany afityną, został oczyszczony na kolumnie MBPTrap HP 1 mL w systemie chromatograficznym ÄKTA. Oczyszczanie zwiększono na kolumnie MBPTrap HP 5 mL i kolumnie XK 26/20 wypełnionej sefarozą dekstrynową® High Performance. Obciążenie białkiem zwiększono pięciokrotnie w każdym kroku (odpowiednio ~10, ~50 i ~250 mg), a czas przebywania wynosił ~2 min dla wszystkich trzech kolumn. Rysunek 6.7 przedstawia warunki pracy dla wszystkich przebiegów i chromatogramy z MBPTrap HP 1 mL i Dextrin Sepharose® High Performance XK 26/20. Rysunek 6.8 przedstawia wyniki SDS-PAGE. Kolumny dały porównywalne wyniki o wysokiej czystości i podobnej wydajności (około 60%, Tabela 6.1), potwierdzając łatwość i powtarzalność skalowania oczyszczania z kolumn MBPTrap HP do kolumny XK 26/20. Alternatywną metodą szybkiego skalowania jest połączenie dwóch lub trzech kolumn MBPTrap HP szeregowo, ale może to zwiększyć ciśnienie wsteczne.
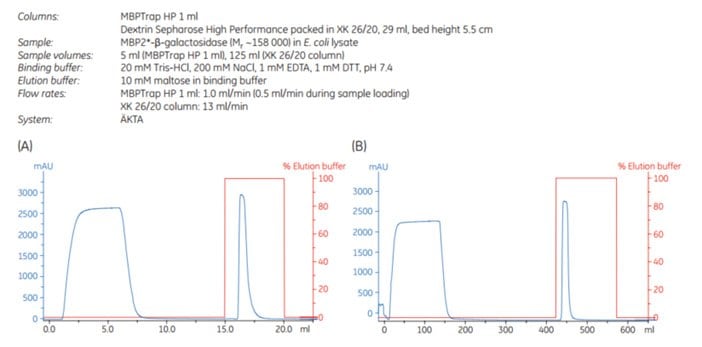
Rysunek 6.7.Skalowanie oczyszczania MBP2*-β-galaktozydazy, (A) MBPTrap HP 1 mL (B) Dekstryna Sefaroza® Wysokowydajna XK 26/20, 29 mL. Nie pokazano chromatogramu dla kolumny MBPTrap 5 mL.
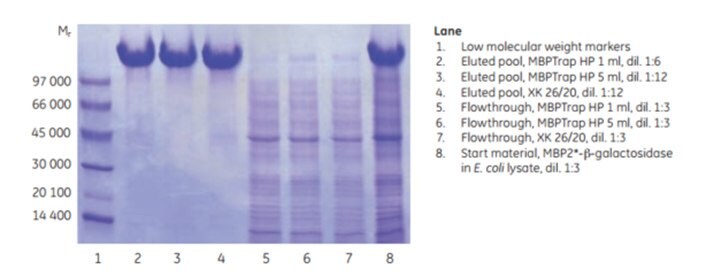
Rysunek 6.8.Analiza SDS-PAGE (warunki redukujące) badania skalowania.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?