推荐产品
生物源
rabbit
品質等級
抗體表格
serum
抗體產品種類
primary antibodies
無性繁殖
polyclonal
物種活性
human
物種活性(以同源性預測)
rat, mouse
製造商/商標名
Chemicon®
技術
ELISA: suitable
dot blot: suitable
immunocytochemistry: suitable
immunohistochemistry: suitable
immunoprecipitation (IP): suitable
western blot: suitable
同型
IgG
UniProt登錄號
運輸包裝
wet ice
目標翻譯後修改
unmodified
基因資訊
human ... APP(351)
mouse ... App(11820)
一般說明
淀粉样蛋白单体蛋白有时可以寡聚为破坏性淀粉样蛋白原纤维。非疾病相关蛋白的淀粉样蛋白构象可以通过部分蛋白错误折叠或变性产生。在疾病状态的寡聚化中,广泛的淀粉样蛋白寡聚化会在神经组织中形成与阿尔茨海默氏症’相关的斑块。
特異性
该抗体识别许多淀粉样蛋白原纤维和原纤维寡聚体共有的通用表位,但不能识别原纤维寡聚体或天然折叠蛋白。 它也可能显示出对Aβ单体的弱反应性,而AB2287则没有。
免疫原
由人Aß42肽制备的原纤维。
應用
抗淀粉样原纤维OC抗体是用于IP、IC、IH、ELISA、WB、DB的抗淀粉样原纤维OC的抗体。
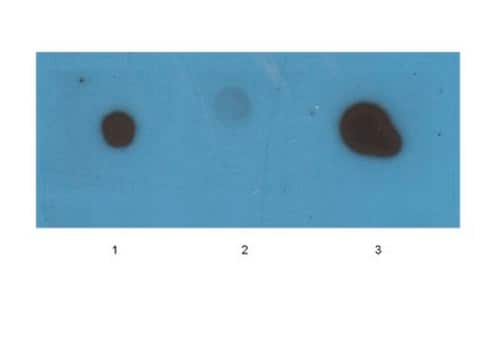
斑点印迹分析:该抗体的1:1,000稀释液检测到单体、寡核苷酸和原纤维中的淀粉样蛋白原纤维。
研究子类别
神经退行性疾病
神经退行性疾病
研究类别
神经科学
神经科学
品質
通过斑点印迹法在单体、寡核苷酸和原纤维中进行评估。
斑点印迹分析:该抗体的1:1,000稀释液检测到单体、寡核苷酸和原纤维中的淀粉样蛋白原纤维。
斑点印迹分析:该抗体的1:1,000稀释液检测到单体、寡核苷酸和原纤维中的淀粉样蛋白原纤维。
外觀
含0.05%叠氮化钠的未纯化兔多克隆抗体血清。
未纯化
儲存和穩定性
自收到之日起在-20°C可稳定保存1年。
使用建议:收到后,在取下瓶盖之前,将小瓶离心并轻轻混合溶液。分装到微量离心管中,并储存于 -20°C。避免反复冻融循环,以免损坏 IgG 和影响产品性能。
使用建议:收到后,在取下瓶盖之前,将小瓶离心并轻轻混合溶液。分装到微量离心管中,并储存于 -20°C。避免反复冻融循环,以免损坏 IgG 和影响产品性能。
分析報告
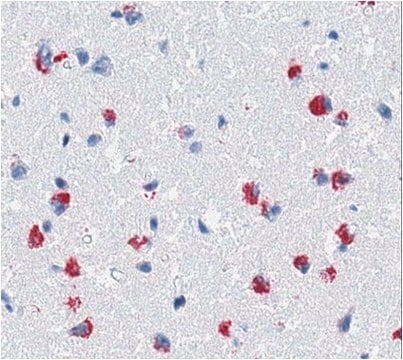
对照
阿尔茨海默病′脑组织
阿尔茨海默病′脑组织
法律資訊
CHEMICON is a registered trademark of Merck KGaA, Darmstadt, Germany
免責聲明
除非我们的产品目录或产品附带的其他公司文档另有说明,否则我们的产品仅供研究使用,不得用于任何其他目的,包括但不限于未经授权的商业用途、体外诊断用途、离体或体内治疗用途或任何类型的消费或应用于人类或动物。
未找到合适的产品?
试试我们的产品选型工具.
儲存類別代碼
10 - Combustible liquids
水污染物質分類(WGK)
WGK 1
Sofia B Carvalho et al.
PloS one, 8(10), e76629-e76629 (2013-10-08)
S100 proteins are small dimeric calcium-binding proteins which control cell cycle, growth and differentiation via interactions with different target proteins. Intrinsic disorder is a hallmark among many signaling proteins and S100 proteins have been proposed to contain disorder-prone regions. Interestingly
Michael H Hayes et al.
Biology open, 5(6), 801-806 (2016-05-25)
A hallmark of Alzheimer's, Huntington's and similar diseases is the assembly of proteins into amyloids rather than folding into their native state. There is an increasing appreciation that amyloids, under specific conditions, may be non-pathogenic. Here we show that amyloids
Functional amyloids in the mouse sperm acrosome.
Guyonnet, B; Egge, N; Cornwall, GA
Molecular and cellular biology null
Rosa Sánchez et al.
Scientific reports, 6, 32801-32801 (2016-09-07)
Amyloids are polymeric structural states formed from locally or totally unfolded protein chains that permit surface reorganizations, stability enhancements and interaction properties that are absent in the precursor monomers. β-Parvalbumin, the major allergen in fish allergy, forms amyloids that are
TGFbeta1 activates c-Jun and Erk1 via alphaVbeta6 integrin.
Luettich, K; Schmidt, C
Molecular Cancer null
我们的科学家团队拥有各种研究领域经验,包括生命科学、材料科学、化学合成、色谱、分析及许多其他领域.
联系技术服务部门