酸化鉄を内包した共役系高分子ナノ粒子の応用例
Dermott O'Callagha, Dr.
Head of Product Development at Stream Bio
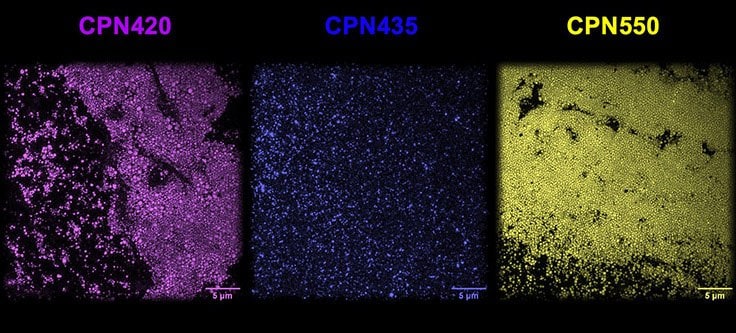
図1英国国立物理学研究所の超解像顕微鏡で撮影されたCPN 420(紫)、CPN 435(藍)、CPN 550(黄)。大きさと明るさが一定であることがわかります。
CPNは優れた特性をもつため、従来の蛍光色素よりも、様々なライフサイエンス分野の応用を広げるものと期待されます。CPNは非常に明るく、QドットやQビーズの100~1000倍の明るさであるというデータが示されています(図2)。さらに、広い範囲の温度とpH2 にわたって安定であるとともに、長時間安定して蛍光を発することができ、常温で24カ月保存しても輝度が低下しないことも示されています(図3)。また、CPNは酸化鉄をコアとしているため、磁石で操作することができ、サンプル内のターゲットの分離やアッセイの高速化が期待できます。マレイミド−チオール反応やアルキンクリックケミストリーをはじめとする様々な反応と、カルボキシ基やビオチン標識と結合するストレプトアビジンなどの表面官能基を利用して、抗体、オリゴヌクレオチド、受容体ないしはリガンド蛋白など様々な標的分子に結合させることができます。これらの特徴により、CPNをウェスタンブロットやラテラルフローなどの診断技術に使用すると3 、従来の方法よりも優れた結果を得ることができます。
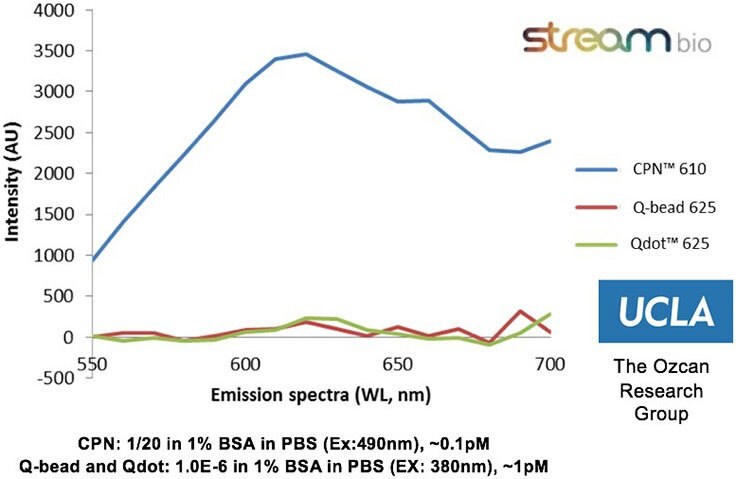
図2カリフォルニア大学ロサンゼルス校のOzcan Research Groupによる実験データ。CPN 610(オレンジ)は同等のQビーズやQドットに比べて最大100~1000倍の明るさを示します。データは、各蛍光色素の発光に最適な励起光で標準的なELISAプレートリーダーを用いて測定されました。

図3CPNは最大24ヶ月間光安定性を維持します。このように、CPNは長期間保存しても蛍光特性を失いません。
診断技術に関するCPNのメリット
CPNは、上記のユニークな特性により、ウェスタンブロット、ラテラルフロー、ELISAなどの診断技術において優位性を発揮します。輝度が非常に高く、低濃度の標的分子であってもはっきりと目に見えるシグナルが得られます。このため、幅広いアッセイ方式とそのリーダーシステムにおいて検出感度が向上します(図4)。さらに、CPNは低濃度でも堅牢で安定した蛍光を発し(図4)、時間の経過とともに減衰しないため、結果を容易に保存することができます。さらに、CPNは発光波長の選択の幅が広いため、複数の標的分子の同時検出によって、検査効率を向上させることもできます。CPNのもう一つの重要な利点は、環境条件下での安定性であり、ポイントオブケア診断に不可欠なラボ外での長期保存と使用を可能にします。これらの特性は、機能性や使いやすさを向上させるだけでなく、現在利用可能な診断マーカーよりも検出能を高めることができます。
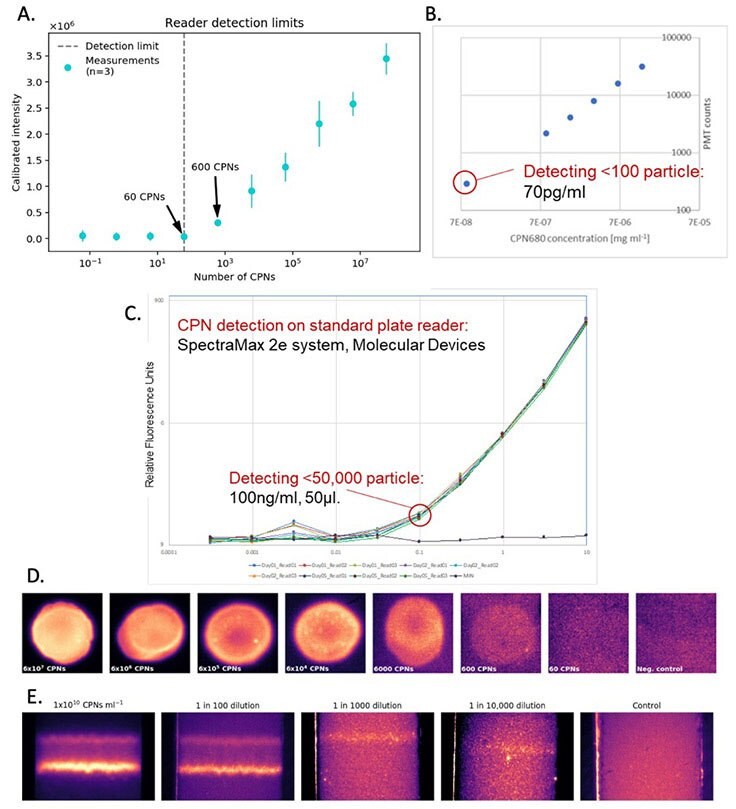
図4CPNによって得られる検出感度。A)CPN量に対するCPNシグナルの較正強度に基づくリーダー検出限界。B)ある濃度範囲におけるCPNの蛍光強度。C)SpectraMax 2eリーダーシステム(Molecular Devices社製)を用いて検出された、様々な濃度におけるCPNの蛍光。D)様々な量のCPNから得られるCPNシグナルの輝度。E)様々なCPN濃度における試験線の輝度。
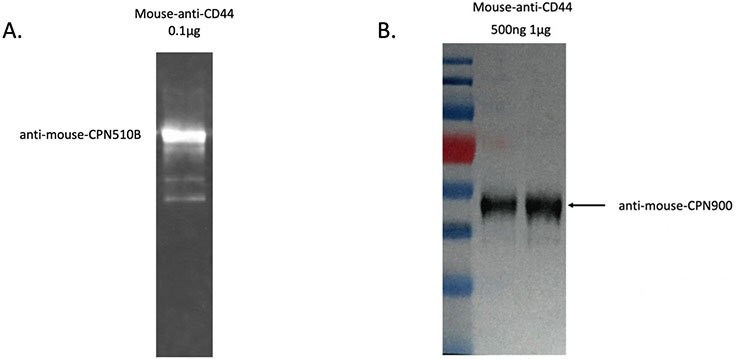
図5A)抗マウス抗体結合CPN 510B(緑)を用いたCPNウェスタンブロットによるマウス抗CD44タンパク質サンプルの検出結果。B)抗マウスCD44タンパク質サンプルの検出に向けた抗マウス抗体結合CPN900(IR-I)を用いたCPNウェスタンブロットの結果。シグナルはChemiDoc(BioRad)により可視化されています。
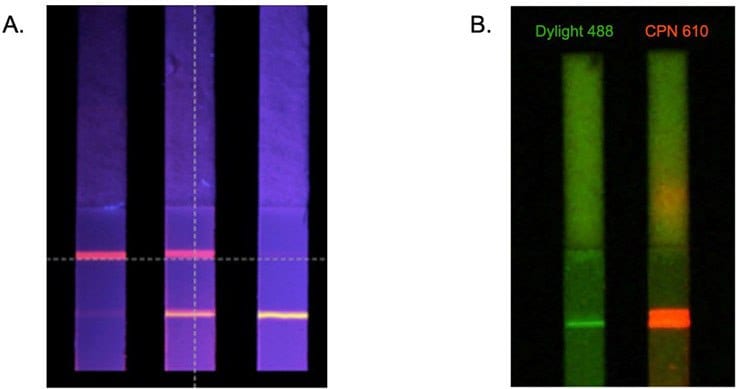
図6A)2つの抗体を同時に検出するCPNを用いたマルチプレックス・ラテラルフロー検出ストリップ。B)一致した条件下でのCPN610(オレンジ)と従来の蛍光色素DyLight™とのテストラインの輝度の比較。
ラテラルフローアッセイは、使いやすく、結果が迅速に得られることから、ポイントオブケア診断によく使用されています4,6 。また、安定した費用対効果の高い検査で高い精度を得ることができるため、研究室以外でも広く使用するのに適しています。CPNはラテラルフローアッセイを強化し、感度を大幅に向上させられることから、迅速診断検査(RDT:rapid diagnostic test)において非常に優れたアプリケーションを有しています。
RDTにCPNを使用することで、現在および将来の多くの医療課題に応える役割を果たすと考えられます。CPNを適切な抗原に結合させることで、ウイルスの検出が可能になります。CPNはリーダーなしでも見ることができる強いシグナルを発しますが、リーダー装置を用いれば、PCRの感度レベルと定量的な結果を容易に得られるようになります(図4A)。携帯型リーダーを併用することで、CPNを用いたウイルス診断法は、これまで研究室内でのみ可能であった感度レベルを達成することができるかもしれません。上述したように、CPNのユニークな特性は、様々な場所で使用するのに十分な堅牢性と安定性を持ちながら、低いウイルスレベルの検出を可能にする可能性があります。現在、この技術をCOVID-19診断検査に応用し、10分以内に有症状キャリアと無症状キャリアの両方を特定するための検討が進められています。さらに、他の病気の検出、さらには農業や食品検査への応用に向けた検査プラットフォームを開発中です。
まとめ
CPNは優れた特性を持つ蛍光ナノ粒子であり、ラテラルフローやウェスタンブロットをはじめとする様々なライフサイエンスアッセイにおいて、感度の向上、安定性の改善、迅速で信頼性の高い結果を提供することができます。この革新的な技術は、研究室での使用だけでなく、携帯可能なポイントオブケア型の迅速診断検査法の開発を可能にし、現在および将来の医療ニーズに応えるものと期待されます。CPNは、迅速な診断を今よりも大きく改善し、この分野を発展させていくでしょう。
Network error: Failed to fetch
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?