医薬品におけるニトロソアミン類不純物試験に対するMillex®シリンジフィルターの評価
ニトロソアミン類不純物試験
医薬品中のニトロソアミン類の検出・定量は医薬品の安全性と品質を確保するうえで不可欠です。ニトロソアミンという化学的不純物は、複数かつ予測困難な経路で合成プロセスに導入され、発がん性や遺伝毒性を有するため患者の健康にリスクを生じることが疑われています1-4。原薬や添加剤中に検出され、2018年以降、バルサルタンなど多数のリコールがありました5,6。
ニトロソアミン類分析の規制要件
米国食品医薬品局(FDA)、欧州医薬品庁(EMA)、医薬品規制調和国際会議(ICH)などの医薬品の規制機関および組織は、医薬品中のニトロソアミン類に関するガイドラインや要件を提供しています。その重要なポイントの概要を表1に記載しています。
これらの規制当局は、ニトロソアミン類不純物に関するガイドラインを積極的に監視・更新し、公衆衛生と安全性を確保しています。医薬品製造業者はこれらのガイドラインおよび要件を遵守し、医薬品のニトロソアミン類による汚染リスクを評価および緩和することが重要です。
ニトロソアミン類分析用の分析方法
EMA、米国FDAなどの世界的規制機関は、医薬品におけるニトロソアミン類分析には頑健な分析手法が重要であることを強調しています。LC-MS/MSは、さまざまな規制機関で共通してニトロソアミン類分析に推奨される分析法です。高性能液体クロマトグラフィー(HPLC)による分離とタンデム質量分析法による検出(MS/MS)を併用することによって、高い感度、選択性、精度が実現します。LC-MS/MSは、複雑なサンプルマトリックス中の微量の多様なニトロソアミン類の検出・定量が可能であり、日常的な分析と規制限度値の遵守に適しています。USP <1469> Procedure 3ではニトロソアミン類の定量にLC-MS/MSを使用しています13。米国FDA、欧州薬局方14、シンガポール健康科学庁(HSA)15、台湾FDA16も、ラニチジンおよびその他の医薬品中のニトロソアミン類測定用のLC-MS/MS法を発表しました。
HPLCと高分解能質量分析法(HPLC-HRMSまたはLC-HRMS)の併用は、ニトロソアミン類分析に用いられるもう1つの重要な技術です。この方法は選択性が高いためニトロソアミン様不純物を実際のニトロソアミン類と識別し、試験結果の信頼性が確保されます。FDAは、LC-HRMS法を開発・バリデーション済みであり17、USP <1469> Procedure 1でもこの方法を概説しています7。
HPLCとUV/Vis検出もニトロソアミン類分析に用いられます。LC-MS/MS法と比べて感度は低いと考えられますが、原材料、溶媒、添加剤の迅速分析法として活用できます。Agence Nationale de Sécurité du Médicament et des Produits de Santé(ANSM)には、HPLC-UVに基づく2つの手法があります18,19。
ガスクロマトグラフィー-タンデム質量分析法(GC-MS/MS)は通常用いられるもう1つのニトロソアミン類分析方法です。本法はニトロソアミン検出感度と特異性に優れており、特に揮発性ニトロソアミン類に有用です。USP <1469>10 、台湾FDA13およびスイス医薬品局20はニトロソアミン類試験にGC-MS/MS法を使用しており、シンガポール健康科学庁(HSA)は、高分解能精密ガスクロマトグラフィー-質量分析法(HRAM-GCMS)21に基づく手法を発表しました。
ニトロソアミン類分析のためのサンプルろ過の要件
上述の手法の大半では、注入前にサンプルをろ過する必要があります。ろ過は注入前のサンプルおよび移動相中の粒子を除去する最も簡単な方法であり、これがHPLC装置の性能に多大な影響を及ぼす可能性があります。粒子は製剤の溶解プロセスで発生し、バルサルタンなどの製剤にきわめて高頻度に認められます。メンブレンフィルターの孔径等級は、サンプル中の粒子を保持できる程度を示し、HPLC法では0.45 µmが一般的です。より小さな粒子(例:2 µm未満の粒子)を充填したカラムを用いる場合およびUHPLCを使用する場合には、0.2 μmのフィルターが推奨されます。先行研究で示されているとおり、同じ孔径のメンブレンフィルターが常に同じ捕捉効率であるとは限らないことに注意することが重要です22。
表2には、世界中の規制機関が発表した特定の方法におけるろ過ステップを一覧しています。ニトロソアミン類分析法では、シリンジフィルターが好まれるフォーマットです。関係のあるシリンジフィルターの重要な特性は、メンブレンフィルターの材質と孔径の2つです。PVDFおよびPTFEは発表されている分析法において最も一般的に使用されているメンブレンフィルターの材質です。一部の事例では、ナイロンおよび親水性ポリプロピレン(例:GHPメンブレン)も言及されています(表2)。これらの方法における孔径は0.2 μm、0.22 μm、0.45 μmです。
試験を行ったシリンジフィルター。(1)Millex® PVDF 0.22 µmおよび(2)Millex® PTFE 0.2 µmの2ロットからそれぞれ3個ずつ、(3)Supplier P PVDF 0.2 µm、(4)Supplier C H-PTFE 0.2 µm、(5)Supplier M PVDF 0.2 µm、(6)Supplier M PTFE 0.2 µmの1ロットからそれぞれ3個ずつのシリンジフィルターを試験しました。
パート1-溶出物。シリンジフィルターにおいてベースラインレベルのニトロソアミン類不純物溶出物が認められるかどうかを決定するため、 希釈液のみ(0.1% v/vギ酸溶液)をUSP <1469>に従ってアイソトープ標識内部標準(IS)でスパイクしました[NDMA-d6およびNMBA-d3では10 µg/mLならびにNDEA-d10/NDBA-d18では1 µg/mL]。サンプルをボルテックスで攪拌し、遠心分離して(10,000 rpm、10分)、上清を13 mmのシリンジフィルターでろ過しました。LC-MS/MSを用いてろ液中の6種類のニトロソアミン化合物を分析しました。1.33~90 ng/mL(NDMA、NMBA、NEIPA、NDIPA、NDBA)および0.66~69.4 ng/mL(NDEA)の外部較正曲線を用いて濃度を決定しました。
パート2-回収率。Valsartan dura(用量80 mg)40 mgをUSP <1469>に従って粉末状にし、1%ギ酸溶液で希釈して、低(L2)濃度でスパイクしました。次にサンプルを遠心分離してろ過した後に、LC-MS/MSで分析しました。
ニトロソアミン類分析用フィルターの評価
多くのLC-MSおよびGC-MSを用いた試験法において、ニトロソアミン類不純物試験の一環としてサンプル注入前のサンプルのろ過を行います。ろ過装置に溶出物が認められないようにすることが、これらの方法のデータの精度や一貫性を維持する上で重要です。また、ある種の分子はシリンジフィルターの部品に結合し、作成されるデータの品質に影響を及ぼす可能性があるため、回収試験の実施も不可欠です。
USP <1469> Procedure 3に基づくバリデーション済みの方法を用いて、シリンジフィルターの評価を実施しました27。このUSP法は、 選択されたサルタン類(バルサルタン、ロサルタンカリウム、オルメサルタン メドキソミル、カンデサルタン シレキセチル、テルミサルタン)中のNDMA、NDEA、NDIPA、NEIPA、NMBA、NDBAの定量に対するLC-MS/MSの使用について述べています。本法の「サンプル溶液」のサブセクションの最後のパートで「孔径0.45 μmの親水性ポリテトラフルオロエチレン(PTFE)フィルターを使用した」ろ過が求められています11。
パート1-溶出物
ニトロソアミン類溶出物について、シリンジろ過ステップのろ液を、1.33~90 ng/mL(NDMA、NMBA、NEIPA、NDIPA、NDBA)および0.66~69.4 ng/mL(NDEA)の外部較正曲線を用いて分析します。図1は、これらの化合物のMRMクロマトグラムの例です。
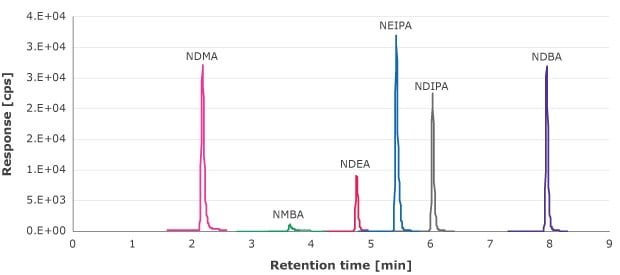
図1.ニトロソアミン標準物質溶液のMRMクロマトグラム(NDMA、NMBA、NEIPA、NDIPA、NDBAでは10 ng/mLおよびNDEAでは6.6 ng/mL)。
定量限度値(LOQ)は、S/N比が10である濃度と定義しています。分析した各ニトロソアミン類不純物の較正曲線の最低濃度は、S/Nが10を超えました。試験を行ったシリンジフィルターのいずれにおいてもこの値以上でニトロソアミン類は検出されませんでした(表5)。
略語:S/N = シグナル/ノイズ比;PVDF = 親水性ポリフッ化ビニリデン;PTFE = 親水性ポリテトラフルオロエチレン;LOQ = 定量下限値;ND = 未検出
特にきわめて感度の高い装置を使用する方法では、ろ過装置に、データ品質に負の影響を及ぼしかねない化学的溶出物が存在しないようにすることが重要です。溶出物は分析対象物のピークと同時に溶出される可能性があるか、または下流分析において予測されないピークとして出現する可能性があり、データの解釈が困難になるため避ける必要があります。溶出物の発生源は、フィルターの脱落、製造プロセスからの残留化学物質、およびフィルターを洗い流す二次化学物質を由来とします。ニトロソアミン化合物などの特定の分析対象物の場合、溶出物がメンブレンの成形プロセス中に偶発的に生成する可能性があります。
パート2-バルサルタンにおける回収率
バルサルタンサンプルを低濃度(L2)の標準物質でスパイクすることによって回収試験を実施しました。調製済みサンプル溶液を、LS-MS/MSにより分析し、外部較正曲線を用いて個々の分析対象物の濃度を算出しました。サンプル溶液中および外部較正溶液中の内部標準のシグナルと分析対象物のシグナルの比(例:NDMA-D6のシグナル/NDMAのシグナル)を決定しました。
表6に、 試験を行ったPVDFおよびPTFEシリンジフィルターの平均回収率を示しています。試験を行ったすべての装置および材質について、すべての化合物の回収率が許容範囲である70~130%31内でした。化合物およびフィルター材質間で一部に若干の差が認められました。例えば、NDBAは回収率が比較的低く(ただし許容範囲内)、これはおそらくろ材または製剤中の成分との疎水性相互作用によるものと考えられました。Millex®親水性PVDFおよびPTFEシリンジフィルターはいずれも、ロット間で一貫した回収率を示しました。
ろ過装置への分析対象物分子の結合により回収率が低下するため、シリンジフィルターの材質を選択する際にはこの点も考慮すべき因子です。ろ過装置(メンブレンフィルターおよびハウジング)の物理化学的特性および分析対象物の化学的性質が結合の程度を決定します。静電的相互作用、水素結合、疎水性相互作用などのさまざまな二次的相互作用がメンブレンフィルターやハウジングへの分析対象物の結合に寄与します32。本試験において、PVDFおよびPTFEメンブレンフィルターを用いたNDMAの回収率が比較的低かった(ただし許容範囲内)理由は、NDMAとメンブレンの疎水性相互作用が原因であると考えられました。NDIPAはPVDFメンブレンによる回収率が低く、この分子はPVDFポリマーとの相互作用がPTFEポリマーとの相互作用とは異なる可能性が示されました。極性官能基を有し、非特異的結合の傾向が強い他のポリマー(ナイロンなど)は結合率が高い可能性が示され、分析対象物の喪失量が多いと考えられます。最も正確な回収率を得るために、米国FDAのニトロソアミン類の試験で推奨されているとおり、サンプル調製時のろ液の最初の1 mLを廃棄することが提案されています23,24。これにより、結合部位が分析対象物で飽和されるため、さらなる分析対象物の喪失が発生しません。私たちは、ナイロンなどのさらに結合率が高いメンブレン材質でこの現象を認めました。
関連アプリケーション
- 低分子試験と品質管理
薬局方の仕様に準拠した低分子医薬品の分析試験と品質管理(QC)は、医薬品開発において極めて重要です。分析化学試験および微生物試験により、低分子が「医薬品等の製造品質管理基準(GMP)」を用いて開発・製造されることが確実になります。
- 局方試験と規制ガイダンス
局方試験は、添加剤や医薬品のリリースに不可欠です。USPやEPなどの国際薬局方では、品質基準が設定されています。薬局方詳述されたこれらの試験および基準遵守は、医薬品成分および製剤に関する基本的な要求事項です。
References
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?