MABN826
Anticorpo anti-fosfo-α-sinucleina (Ser129), clone 81A
clone 81A, from mouse
Sinonimo/i:
Alpha-synuclein, NACP, Non-A beta component of AD amyloid, Non-A4 component of amyloid precursor, Synuclein alpha-140
About This Item
Prodotti consigliati
Origine biologica
mouse
Livello qualitativo
Forma dell’anticorpo
purified antibody
Tipo di anticorpo
primary antibodies
Clone
81A, monoclonal
Reattività contro le specie
mouse, human
tecniche
electron microscopy: suitable
immunocytochemistry: suitable
immunofluorescence: suitable
immunohistochemistry: suitable (paraffin)
western blot: suitable
Isotipo
IgG2aκ
N° accesso NCBI
N° accesso UniProt
Condizioni di spedizione
dry ice
modifica post-traduzionali bersaglio
phosphorylation (pSer129)
Informazioni sul gene
human ... SNCA(6622)
Descrizione generale
Specificità
Immunogeno
Applicazioni
Neuroscienze
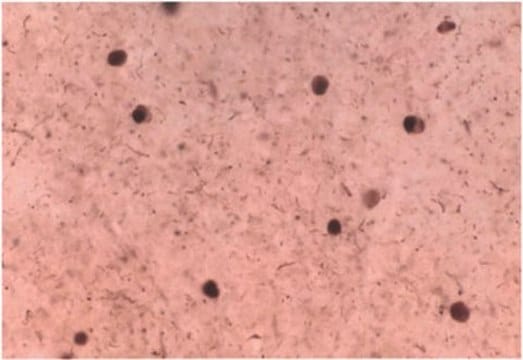
Immunocytochemistry Analysis: A representative lot detected Ser129-phosphorylated α-synuclein in Lewy bodies-/LB- and Lewy-neurite-/LN-like inclusions in cultured embryonic hippocampal neurons from wild-type mice and mice carrying human mutant P301S tau transgene, but not Snca-/- mice, upon exposure to preformed α-synuclein fibrils (pffs) from C-terminally truncated, Myc-tagged α-synuclein (Guo, J.L., and Giasson, B.I. (2013). Cell. 154(1):103-117).
Electron Microscopy Analysis: A representative lot detected phosphorylated α-synuclein in close physical associations of tau in filamentous structures within neuronal processes of human P301S mutant tau transgenic mouse embryo hippocampal neurons exposed to α-synuclein fibrils formed by repeated rounds of self-seeding using C-terminally truncated, Myc-tagged α-synuclein (Guo, J.L., and Giasson, B.I. (2013). Cell. 154(1):103-117).
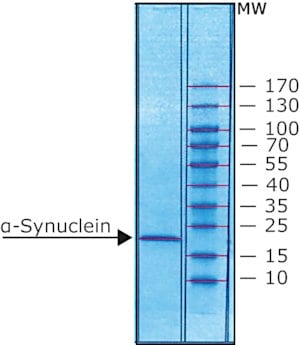
Western Blotting Analysis: A representative lot detected phosphorylation of the Triton-insoluble α-synuclein formed in cultured mouse embryonic hippocampal neurons upon exposure to preformed α-synuclein fibrils (pffs) from C-terminally truncated, Myc-tagged α-synuclein (Guo, J.L., and Giasson, B.I. (2013). Cell. 154(1):103-117).
Western Blotting Analysis: A representative lot detected Ser129 phosphorylation of Triton-insoluble, but not Triton-soluble, α-synuclein in the cingulate cortex extracts from DLB (dementia with Lewy bodies) patients and the cerebella extracts from patients with multiple systems atrophy (MSA) (Waxman, E.A., et al. (2008). J. Neuropathol. Exp. Neurol. 67(5):402-416).
Western Blotting Analysis: A representative lot detected CK1- and CK2-catalyzed alpha-synuclein Ser129 phosphorylation, but not CK1-catalyzed α-synuclein Ser87 phosphorylation, nor non-phosphorylated α-synuclein (Waxman, E.A., et al. (2008). J. Neuropathol. Exp. Neurol. 67(5):402-416).
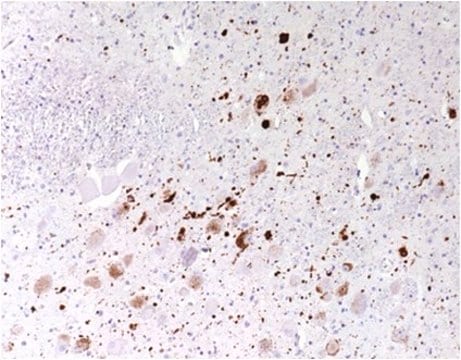
Immunohistochemistry Analysis: A representative lot detected pathologic inclusions-associated α-synuclein Ser129 phosphorylation in paraffin-embedded brain tissue sections from patients with PD (Parkinson′s disease), DLB (dementia with Lewy bodies) and MSA (multiple systems atrophy), while clone 81A detected no α-synuclein Ser129 phosphorylation associated with neurofibrillary tangles in the hippocampus of a patient with Alzheimer′s disease (Waxman, E.A., et al. (2008). J. Neuropathol. Exp. Neurol. 67(5):402-416).
Immunofluorescence Analysis: A representative lot detected pathologic inclusions-associated α-synuclein Ser129 phosphorylation by fluorescent immunohistochemistry in paraffin-embedded cingulate cortex sections from a patient with LB variant of Alzheimer′s disease (LBVAD) and in the cerebellum sections from a patient with multiple systems atrophy (MSA) (Waxman, E.A., et al. (2008). J. Neuropathol. Exp. Neurol. 67(5):402-416).
Note: Incubating the transferred membrane with a combination of 4% paraformaldehyde and 0.01 ~ 0.1% glutaraldehyde is reported to produce an approximately 10-fold increase in the detection sensitivity of α-synuclein Ser129 phosphorylation by Western blotting. If not fixed, α-synuclein monomers can detach from the transferred membrane during incubation (Sasaki, A., et al. (2015). Sci. Rep. 5:14211).
Malattie neurodegenerative
Qualità
Analisi di isotipizzazione: questo anticorpo monoclonale è stato identificato come IgG2aκ mediante un test di isotipizzazione.
Descrizione del bersaglio
Stato fisico
Stoccaggio e stabilità
Esclusione di responsabilità
Not finding the right product?
Try our Motore di ricerca dei prodotti.
Codice della classe di stoccaggio
12 - Non Combustible Liquids
Classe di pericolosità dell'acqua (WGK)
WGK 1
Punto d’infiammabilità (°F)
Not applicable
Punto d’infiammabilità (°C)
Not applicable
Certificati d'analisi (COA)
Cerca il Certificati d'analisi (COA) digitando il numero di lotto/batch corrispondente. I numeri di lotto o di batch sono stampati sull'etichetta dei prodotti dopo la parola ‘Lotto’ o ‘Batch’.
Possiedi già questo prodotto?
I documenti relativi ai prodotti acquistati recentemente sono disponibili nell’Archivio dei documenti.
Il team dei nostri ricercatori vanta grande esperienza in tutte le aree della ricerca quali Life Science, scienza dei materiali, sintesi chimica, cromatografia, discipline analitiche, ecc..
Contatta l'Assistenza Tecnica.