推荐产品
一般說明
通过丝氨酸或苏氨酸残基上的羟基部分通过β-连接的N-乙酰氨基葡萄糖(β-GlcNAc)对蛋白质进行翻译后修饰称为O-连接的β-GlcNAc或简称为O-GlcNAc。O-GlcNAc是所有动植物核质区室中最丰富的翻译后修饰之一。与其他类型的蛋白质糖基化不同,O-GlcNAc仅发生在核和细胞质区室中,通常不进行进一步修饰以形成更细长的结构。此外,O-GlcNAc糖基化是一个高度动态且可逆的过程。O-GlcNAc转移酶(OGT)将O-GlcNAc附着在特定丝氨酸或苏氨酸残基的蛋白质上,而O-GlcNAcase催化从蛋白质中去除/水解O-GlcNAc。实际上,O-GlcNAc糖基化和丝氨酸/苏氨酸磷酸化之间的动态相互作用在调节细胞信号传导中起着重要作用。Tau和RNA聚合酶II(Pol II)是两种众所周知的蛋白质,它们通过O-GlcNAc糖基化进行修饰。在阿尔茨’海默氏病的人脑中,tau被广泛磷酸化,而O-GlcNAc糖基化较少。类似地,当转录的延伸阶段开始时,O-GlcNAc被去除并在Poly II CTD上被O-磷酸盐取代。
特異性
克隆CTD110.6特异性检测到具有β-O-连接GlcNAc的丝氨酸和苏氨酸残基,但未检测α-O-连接GlcNAc的丝氨酸和苏氨酸残基。GlcNAc(而非GalNAc)的存在消除了对靶标修饰的检测。克隆CTD110.6不能识别具有未修饰丝氨酸和苏氨酸残基的肽(Comer,F.I.,et al.(2001).Anal.Biochem.293(2):169-177)。
目标修饰不是物种特异性的。
免疫原
具有O-GlcNAc修饰的丝氨酸残基的KLH偶联肽。
表位:β-O-连接的GlcNAc。
應用
抗O-GlcNAc抗体,克隆CTD110.6是抗O-GlcNAc的抗体,用于蛋白质印迹、ELISA、免疫沉淀。
研究子类别
一般翻译后修饰
一般翻译后修饰
研究类别
信号传导
信号传导
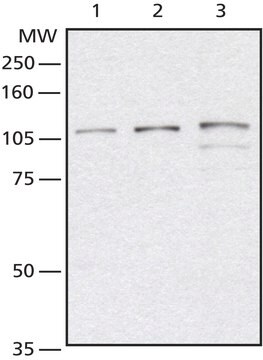
蛋白质印迹分析:1.0 µg/mL样品的代表性批次在7.5-15 µg野生型小鼠胚胎成纤维细胞(MEF)裂解物中检测到O-GlcNAc糖基化蛋白,但未检测到O-GlcNAc转移酶/OGT缺陷型MEF裂解物(由Dr.Natasha Zachara和Gokben Yildirir,M.S.提供)。
ELISA分析:一个代表性批次检测到具有单个O-GlcNAc糖基化丝氨酸或苏氨酸的RNA聚合酶II C末端结构域(CTD)肽(YSPTSPS),但未检测到相应的未修饰肽(Comer,F.I.,et al.(2001).Anal.Biochem.293(2):169-177)。
免疫沉淀分析: 一个代表性批次免疫沉淀来自人多能干细胞(hPSC)的O-GlcNAc糖基化蛋白(Maury,J.J.,et al.(2013).Stem Cell Res. 11(2):926-937)。
免疫沉淀分析: 一个代表性批次免疫沉淀来自HeLa细胞提取物的O-GlcNAc糖基化蛋白(Comer,F.I.,et al.(2001).Anal.Biochem.293(2):169-177)。
蛋白质印迹分析:一个代表性批次在未分化、分化和终末分化的人多能干细胞(hPSC)中检测到相似水平的细胞O-GlcNAc糖基化(Maury,J.J.,et al.(2013).Stem Cell Res. 11(2):926-937)。
蛋白质印迹分析:一个代表性批次检测到具有β-O-连接GlcNAc的BSA偶联的RNA聚合酶II C末端结构域(CTD)肽(YSPTSPS),未检测到不具有α-O-连接GlcNAc的该肽或相应的未修饰肽。GlcNAc(而非GalNAc)的存在消除了目标条带的检测(Comer,F.I.,et al.(2001).Anal.Biochem.293(2):169-177)。
蛋白质印迹分析:一个代表性批次检测到HeLa核提取物中的O-GlcNAc糖基化蛋白,以及通过小麦胚芽凝集素(WGA)柱从HeLa核&胞质提取物中纯化的O-GlcNAc糖基化蛋白。在免疫印迹之前用免疫原肽阻断抗体消除了靶条带检测(Comer,F.I.,et al.(2001).Anal.Biochem.293(2):169-177)。
蛋白质印迹分析:一个代表性批次在用氨基葡萄糖苷酶抑制剂PUGNAc和己糖胺途径中间体氨基葡萄糖处理的Jurkat细胞中检测到O-GlcNAc糖基化蛋白的上调(Comer,F.I.,et al.(2001).Anal.Biochem.293(2):169-177)。
ELISA分析:一个代表性批次检测到具有单个O-GlcNAc糖基化丝氨酸或苏氨酸的RNA聚合酶II C末端结构域(CTD)肽(YSPTSPS),但未检测到相应的未修饰肽(Comer,F.I.,et al.(2001).Anal.Biochem.293(2):169-177)。
免疫沉淀分析: 一个代表性批次免疫沉淀来自人多能干细胞(hPSC)的O-GlcNAc糖基化蛋白(Maury,J.J.,et al.(2013).Stem Cell Res. 11(2):926-937)。
免疫沉淀分析: 一个代表性批次免疫沉淀来自HeLa细胞提取物的O-GlcNAc糖基化蛋白(Comer,F.I.,et al.(2001).Anal.Biochem.293(2):169-177)。
蛋白质印迹分析:一个代表性批次在未分化、分化和终末分化的人多能干细胞(hPSC)中检测到相似水平的细胞O-GlcNAc糖基化(Maury,J.J.,et al.(2013).Stem Cell Res. 11(2):926-937)。
蛋白质印迹分析:一个代表性批次检测到具有β-O-连接GlcNAc的BSA偶联的RNA聚合酶II C末端结构域(CTD)肽(YSPTSPS),未检测到不具有α-O-连接GlcNAc的该肽或相应的未修饰肽。GlcNAc(而非GalNAc)的存在消除了目标条带的检测(Comer,F.I.,et al.(2001).Anal.Biochem.293(2):169-177)。
蛋白质印迹分析:一个代表性批次检测到HeLa核提取物中的O-GlcNAc糖基化蛋白,以及通过小麦胚芽凝集素(WGA)柱从HeLa核&胞质提取物中纯化的O-GlcNAc糖基化蛋白。在免疫印迹之前用免疫原肽阻断抗体消除了靶条带检测(Comer,F.I.,et al.(2001).Anal.Biochem.293(2):169-177)。
蛋白质印迹分析:一个代表性批次在用氨基葡萄糖苷酶抑制剂PUGNAc和己糖胺途径中间体氨基葡萄糖处理的Jurkat细胞中检测到O-GlcNAc糖基化蛋白的上调(Comer,F.I.,et al.(2001).Anal.Biochem.293(2):169-177)。
品質
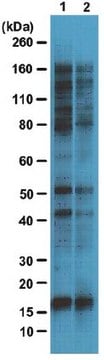
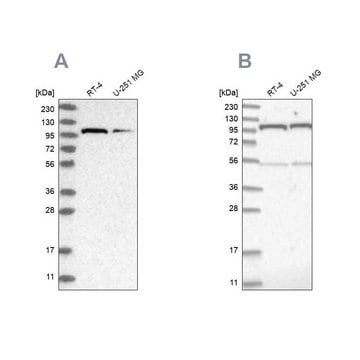
通过蛋白质印迹法在HeLa细胞裂解物中进行评价。
蛋白质印迹分析:4.0 µg/mL的该抗体在10 µg HeLa细胞裂解物中检测到O-GlcNAc糖基化蛋白。
蛋白质印迹分析:4.0 µg/mL的该抗体在10 µg HeLa细胞裂解物中检测到O-GlcNAc糖基化蛋白。
標靶描述
可变,取决于O-GlcNAc糖基化蛋白的大小。
外觀
形式:纯化
纯化的小鼠单克隆IgMκ抗体,溶于含0.05%叠氮化钠的PBS中。
儲存和穩定性
自接收之日起,在2-8°C下可稳定保存1年。
其他說明
浓度:请参考特定批次的数据表。
免責聲明
除非我们的目录或产品随附的其他公司文件中另有说明,否则我们的产品预期仅用于研究用途,不得用于任何其他目的,包括但不限于未经授权的商业用途、体外诊断用途、离体或体内治疗用途或对人类或动物的任何类型的消费或应用。
Not finding the right product?
Try our 产品选型工具.
儲存類別代碼
10 - Combustible liquids
水污染物質分類(WGK)
WGK 2
閃點(°F)
Not applicable
閃點(°C)
Not applicable
Giang Le Minh et al.
Frontiers in oncology, 13, 1141834-1141834 (2023-05-08)
Breast tumor development is regulated by a sub-population of breast cancer cells, termed cancer stem-like cells (CSC), which are capable of self-renewing and differentiating, and are involved in promoting breast cancer invasion, metastasis, drug resistance and relapse. CSCs are highly
Manuel González-Cuesta et al.
Journal of the American Chemical Society, 144(2), 832-844 (2022-01-06)
Owing to its roles in human health and disease, the modification of nuclear, cytoplasmic, and mitochondrial proteins with O-linked N-acetylglucosamine residues (O-GlcNAc) has emerged as a topic of great interest. Despite the presence of O-GlcNAc on hundreds of proteins within
Yaowen Zhang et al.
Journal of genetics and genomics = Yi chuan xue bao, 50(12), 948-959 (2023-06-08)
Protein O-GlcNAcylation is a monosaccharide post-translational modification maintained by two evolutionarily conserved enzymes, O-GlcNAc transferase (OGT) and O-GlcNAcase (OGA). Mutations in human OGT have recently been associated with neurodevelopmental disorders, although the mechanisms linking O-GlcNAc homeostasis to neurodevelopment are not
Meng-Jie Zhao et al.
EMBO reports, 22(6), e51649-e51649 (2021-04-16)
Pathological TDP-43 aggregation is characteristic of several neurodegenerative diseases, including amyotrophic lateral sclerosis (ALS) and frontotemporal lobar degeneration (FTLD-TDP); however, how TDP-43 aggregation and function are regulated remain poorly understood. Here, we show that O-GlcNAc transferase OGT-mediated O-GlcNAcylation of TDP-43
Kamau Fahie et al.
Current protocols, 1(5), e129-e129 (2021-05-19)
O-GlcNAc is a common post-translational modification of nuclear, mitochondrial, and cytoplasmic proteins that regulates normal physiology and the cell stress response. Dysregulation of O-GlcNAc cycling is implicated in the etiology of type II diabetes, heart failure, hypertension, and Alzheimer's disease
我们的科学家团队拥有各种研究领域经验,包括生命科学、材料科学、化学合成、色谱、分析及许多其他领域.
联系技术服务部门