AG210
Proteína priónica, recombinante
Sinónimos:
PrP, CD230
Iniciar sesiónpara Ver la Fijación de precios por contrato y de la organización
About This Item
Código UNSPSC:
12352203
eCl@ss:
32160702
NACRES:
NA.26
Productos recomendados
origen biológico
bovine
Nivel de calidad
Análisis
>95% (total protein)
formulario
liquid
fabricante / nombre comercial
Chemicon®
técnicas
cell based assay: suitable
Nº de acceso NCBI
Nº de acceso UniProt
Condiciones de envío
dry ice
Información sobre el gen
bovine (calf) ... PRNP(281427)
Descripción general
La parte madura de longitud completa etiquetada con histidina de la PrP bovina (25-244) se expresa en E. coli BL21, se solubiliza a partir de cuerpos de inclusión en guanidina-HCl 6 M y se purifica mediante cromatografía en Ni(II)-nitriloacetato agarosa seguida de HPLC de fase inversa (columna C4)
Las enfermedades priónicas o encefalopatías espongiformes transmisibles son enfermedades neurodegenerativas que afectan tanto a los seres humanos como a los animales (Prusiner 1998). Todas las enfermedades priónicas comparten el mismo mecanismo patógeno molecular que implica la conversión de la proteína priónica celular normal (PrPc) en una forma insoluble en detergente no iónico y parcialmente resistente a las proteasas (PrPSc) (Pan et al 1993). Tanto el PrPSc como el PrPc están codificados dentro de un único exón de un gen cromosómico como una proteína de ~ 250 aminoácidos (Basler et al 1986). Muchos PrP de mamíferos tienen una secuencia señal N-terminal de 22 aminoácidos (Hope et al 1986; Turk et al. 1988) y una secuencia señal C-terminal de 23 aminoácidos para la fijación de un ancla de glucosilfosfatidilinositol (Stahl et al. 1987, 1990). La proteína madura de 209 aminoácidos contiene un enlace disulfuro (Turk et al 1988) y tiene dos sitios de glucosilación ligados a la asparagina (Endo et al 1989; Oesch et al. 1995).
Aplicación
Antígeno en la detección inmunoquímica convencional de la EEB.
El usuario final debe determinar la dilución de trabajo óptima.
El usuario final debe determinar la dilución de trabajo óptima.
Categoría de investigación
Neurociencia
Neurociencia
Subcategoría de investigación
Enfermedades neurodegenerativas
Enfermedades neurodegenerativas
Forma física
Líquido en tampón de acetato de sodio 10 mM, pH 4,0, con azida sódica al 0,01 %.
Almacenamiento y estabilidad
Conservar a -20°C en alícuotas no diluidas durante un máximo de 6 meses después de la fecha de recepción. Evite ciclos repetidos de congelación y descongelación.
Nota de análisis
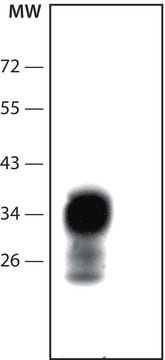
La PrPc aparece como una banda única de unos 27 kD en SDS-PAGE
Información legal
CHEMICON is a registered trademark of Merck KGaA, Darmstadt, Germany
Cláusula de descargo de responsabilidad
Salvo que se indique lo contrario en nuestro catálogo o en otra documentación de la empresa que acompañe al producto, nuestros productos están indicados sólo para investigación y no deben utilizarse para ningún otro propósito, como, entre otros, usos comerciales no autorizados, diagnóstico in vitro, usos terapéuticos ex vivo o in vivo o cualquier tipo de consumo o aplicación en humanos o animales.
Código de clase de almacenamiento
12 - Non Combustible Liquids
Clase de riesgo para el agua (WGK)
WGK 2
Punto de inflamabilidad (°F)
Not applicable
Punto de inflamabilidad (°C)
Not applicable
Certificados de análisis (COA)
Busque Certificados de análisis (COA) introduciendo el número de lote del producto. Los números de lote se encuentran en la etiqueta del producto después de las palabras «Lot» o «Batch»
¿Ya tiene este producto?
Encuentre la documentación para los productos que ha comprado recientemente en la Biblioteca de documentos.
Scrapie and cellular PrP isoforms are encoded by the same chromosomal gene.
Basler, K, et al.
Cell, 46, 417-428 (1986)
Purification and properties of the cellular and scrapie hamster prion proteins.
Turk, E, et al.
European Journal of Biochemistry, 176, 21-30 (1988)
Prions.
Prusiner, S B
Proceedings of the National Academy of Sciences of the USA, 95, 13363-13383 (1998)
The major polypeptide of scrapie-associated fibrils (SAF) has the same size, charge distribution and N-terminal protein sequence as predicted for the normal brain protein (PrP).
Hope, J, et al.
The Embo Journal, 5, 2591-2597 (1986)
Identification of glycoinositol phospholipid linked and truncated forms of the scrapie prion protein.
Stahl, N, et al.
Biochemistry, 29, 8879-8884 (1990)
Nuestro equipo de científicos tiene experiencia en todas las áreas de investigación: Ciencias de la vida, Ciencia de los materiales, Síntesis química, Cromatografía, Analítica y muchas otras.
Póngase en contacto con el Servicio técnico