Tipps für die Optimierung von Immunfluoreszenzprotokollen: damit das beste Bild erzielt wird
- Immunfärbung mit fluoreszierenden Antikörpern
- Fluoreszenz-Immunnachweis für die ICC: Schritt für Schritt
- Auswahl der Antikörper und Fluorophore
- Zusätzliche Überlegungen bei der Auswahl von Fluorophoren
- Programm zum Schutz der Fluoreszenz: Verlängern der Lebensdauer fluoreszierender Antikörper und Reagenzien
- Auswahl von Antikörpern: Färbetechnik
- Antikörperauswahl: zielgerichtet, spezifische Reaktivität
- Versuchskontrollen in der IF-ICC
- Insider-Tipps für ein optimales Signal und die Überwindung des Hintergrunds mit IF-ICC
- Zugehörige Produkte
Immunfärbung mit fluoreszierenden Antikörpern
Die Immunfluoreszenz (IF), bei der ein Antikörper an ein Molekül konjugiert ist, das bei Laseranregung fluoresziert, wird u. a. für die Lokalisation von Proteinen, die Bestätigung posttranslationaler Modifikationen oder Aktivierungen und die Ermittlung der Nähe zu bzw. die Komplexbildung mit anderen Proteinen verwendet. Die Immunzytochemie (ICC) ist eine etablierte Technik, bei der Antikörper an Ziele in Zellproben gebunden werden. Coons et al beschrieben 1942 erstmals den Immunnachweis unter Verwendung eines fluoreszierenden Reportermoleküls. Die Kombination von Immunfluoreszenz und Immunzytochemie liefert nicht nur Informationen über subzelluläre Ziele, sondern auch einige der überzeugendsten visuellen Daten in den Life Sciences. In diesem Leitfaden berichten Wissenschaftler, die sich mit Antikörpern befassen, darüber, was wir gelernt haben, damit Sie das bestmögliche Bild aus Ihren IF-ICC-Versuchen erhalten.
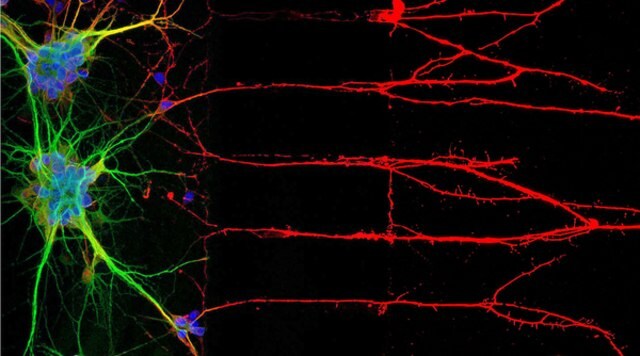

Abbildung 1: In der Immunzytochemie (ICC) werden Proteine lokalisiert, die mit Neuronenkernen, Soma und Axonen assoziiert sind (links). Rechts: Immunfluoreszenzfärbung der menschlichen Zelllinie U-251 MG.

Abbildung 2.Fluoreszenz-Immunnachweis
Die Optimierung einiger Schritte eines Immunfluoreszenzprotokolls kann erforderlich sein, damit auf der Grundlage von Faktoren wie der subzellulären Lage des Ziels und der Antigeneigenschaften die besten Ergebnisse erzielt werden.
Probenvorbereitung:
Unabhängig vom Zellwachstumsformat beginnt eine erfolgreiche IF-ICC-Bildgebung mit der Gewinnung gesunder Proben in der geeigneten Kulturdichte.
Suspensionszelle:
Die Zelltypen können zur Entfernung von Medien gewaschen und dann in Röhrchen mit geringem Volumen gefärbt werden, bevor sie für die mikroskopische Untersuchung auf Objektträger aufgebracht werden. Die Suspensionen sollen zunächst mikroskopisch auf ihre Morphologie untersucht werden und die/den für die Zelllinie empfohlene Konfluenz/Titer nicht überschreiten, um für die Immunzytochemie geeignet zu sein. Gesunde, subkonfluente Kulturen sind weder übermäßig trüb noch weisen sie eine Gelbfärbung auf, die auf eine Übersäuerung des Mediums hinweist. Bei der mikroskopischen Untersuchung sollen die Zellen hell und rund erscheinen. Die prozentuale Lebensfähigkeit kann mittels Hämozytometer und Trypanblau-Ausschluss bestimmt werden. Nach dem Waschen sollen die Zellen mit 1–2 x 106 Zellen/ml resuspendiert werden, entweder für die ICC-Färbung in Lösung oder für die Ausstrichfärbung auf speziell behandelten Objektträgern, um die Adhäsion der Zellen zu verbessern.
Wenn adhärente Zellen kultiviert (und möglicherweise behandelt) werden, um die Auswirkungen auf die Zielexpression durch IF-ICC zu untersuchen, können die Zellen auf Kammerobjektträgern ausgesät werden. Dabei handelt es sich um Objektträger, die für die optische Bildgebung optimiert sind, und auf denen Ein- oder Mehrkammer-Suprastrukturen angebracht sind, welche die Zugabe von Nährmedien ermöglichen. Kammerobjektträger ermöglichen den direkten Übergang von der Zellkultur zur Untersuchung und Bildgebung. Adhärente Zelltypen können auch auf Objektträger-Deckgläsern ausgesät werden, die in mit Medien gefüllte Wells getaucht werden. Diese werden anschließend gefärbt und zur Bildgebung auf Objektträgern angebracht.
Unabhängig von der Kulturoberfläche und dem Gefäßkonzept soll das Zellwachstum auf Deckgläsern oder in Objektträgerkammern sorgfältig überwacht werden, damit die Zellen aus der Kultur entfernt und für die Immunzytochemie fixiert werden können, bevor sie überwuchern. Die Zellen werden häufig abgebildet, wenn die Konfluenz (die von den Zellen bedeckte Oberfläche) im Bereich zwischen 50 und 80 % liegt. Wenn die Lebensfähigkeit der Zellen definitiv vor der Immunfärbung bestimmt werden muss, setzen einige Forschende Farbstoffe wie Ethidium-Homodimer ein, einen Kernmarker, der die intakten Zellmembranen lebender Zellen nicht durchdringen kann. So kann die Zusatzfärbung mit DAPI, das in den Kernen sowohl lebensfähiger als auch nicht lebensfähiger Zellen fluoresziert, dazu beitragen, die prozentuale Lebensfähigkeit als die Anzahl der mit Ethidium gefärbten Kerne/Anzahl der doppelt gefärbten Kerne zu quantifizieren. Alternativ sind kommerzielle Kits für lebende und tote Zellen erhältlich, in denen häufig Calcein und Propidiumiodid verwendet werden, um lebende von toten Zellen zu unterscheiden.
Fixierung:
Die Fixierung und Permeabilisierung kann in einem einzelnen Schritt mit organischen Fixiermitteln wie Alkohol und Aceton erfolgen. Organische Lösungsmittel sollen jedoch nicht verwendet werden, wenn die Integrität der Lipide erhalten bleiben muss, z. B. wenn das Zielantigen mit der Membran assoziiert ist. Obwohl Formaldehyd (häufig in seiner polymeren Form Paraformaldehyd verkauft und verwendet) eine gängige Wahl ist, die Zersetzung aufhält und Proteine fixiert, können quervernetzende Aldehyde den Zugang von Antikörpern zu einigen Antigenen behindern und sollen daher in der niedrigsten Konzentration verwendet werden, durch welche die Struktur nach einer Inkubationszeit von 10-20 Minuten effektiv bewahrt wird, üblicherweise zwischen 1 und 4 % bei (Para)formaldehyd. HINWEIS: Da es eine Autofluoreszenzquelle ist, soll Glutaraldehyd in IF-Fixierungsprotokollen vermieden werden.
Antigenrückgewinnung:
Einige Zielepitope können durch Komplexbildung in einer überfüllten zellulären Mikroumgebung oder durch Fixierungstechniken maskiert werden. Techniken zur Antigenrückgewinnung verbessern nachweislich den Zugang von Antikörpern zu bestimmten Antigenzielen, sollen aber bei der Arbeit mit Zellen auf Objektträgern mit äußerster Vorsicht eingesetzt und vorab getestet werden, da die Hitze oder die chemischen Bedingungen, denen die Zellen ausgesetzt werden, für ICC-Proben in der Regel zu extrem sind.
Permeabilisierung:
Die Detergenzien Triton-X oder Tween-20 werden häufig verwendet, um fixierte Zellen wirksam zu permeabilisieren. Diese Detergenzien lösen jedoch Lipide willkürlich auf und können zerstörerischer sein als Saponin, ein Glykosid auf Pflanzenbasis, das die Membran durch selektive Auflösung von Cholesterinen perforiert und die Membranen der Organellen im Wesentlichen intakt belässt. Befindet sich das Zielmolekül in membrangebundenen Strukturen innerhalb der Zelle, sind robustere Detergenzien wie Triton-X, Tween-20, die Brij-Detergenzien oder NP-40 besser dazu geeignet, den Antikörperzugang zu ermöglichen. Saponin ist ein sanfter Permeabilisator, der die Integrität von Oberflächenantigenen bewahrt, aber möglicherweise nicht für die Permeabilisierung intrazellulärer Membranen geeignet ist, um Antikörpern Zugang zu Zielen im Zellkern oder anderen Organellen zu verschaffen. Da die Wirkung von Saponin reversibel sein kann und daher beim Waschen verloren geht, soll die Verwendung von Saponin während des gesamten Färbeprotokolls beibehalten werden, um den Zugang zu Antikörpern sicherzustellen.
Blockieren:
Eine Lösung mit bis zu 5 % normalem Serum der Spezies, in welcher der Sekundärantikörper gezüchtet wurde, blockiert wirksam dessen unspezifische Bindung. Wenn kein Serum zur Verfügung steht, ist ein Ansatz, der an jeden Sekundärantikörper adaptiert, die Verwendung eines allgemeineren Proteinblockers wie Rinderserumalbumin (BSA) in einer ähnlichen Verdünnung in PBS. In einigen Laboren wird eine Kombination aus Serum und BSA eingesetzt, um sowohl eine wirtsspezifische als auch eine allgemeine Blockierung der Antikörper zu erreichen. BSA wird häufig gefriergetrocknet und zu Flüssigkeit rekonstituiert geliefert. Daher soll es gefiltert und/oder regelmäßig auf Partikel untersucht werden, die sich auf den Proben ablagern und Artefakte aufgrund der Färbung verursachen können. Die Blockierung kann während des gesamten Immunfluoreszenzprotokolls aufrechterhalten werden, indem die Antikörper im Blockierungspuffer verdünnt werden.
Auswahl der Antikörper und Fluorophore
Auswahl der Fluorophore
Bei der Planung eines Fluoreszenzversuchs zur Untersuchung von Zellen mittels ICC soll immer zuerst die optische Konfiguration des für die Analyse zu verwendenden Mikroskops berücksichtigt werden. IF-ICC-Protokolle können zur Markierung eines einzelnen Targets verwendet werden, aber viele Fluoreszenzmikroskop-Konfigurationen können Multiplexing oder die gleichzeitige Färbung mehrerer Targets zusammen mit dem Zellkern ermöglichen. Nachfolgend ist eine Beispielpalette für die Färbung von drei Targets und dem Zellkern dargestellt:
Fluoreszenzmikroskope verfügen über spezifische Konfigurationen für Anregung und Emission. Mikroskope sind werksseitig mit hochintensiven Lichtquellen wie Bogenlampen oder Lasern ausgestattet, die Licht bei einer bestimmten Wellenlänge aussenden, durch die kompatible Fluorophore angeregt werden können. Filtereinheiten erfassen einen Wellenlängenbereich des von angeregten Fluorophoren emittierten Lichts, der breit sein kann, um die erfasste Emission zu maximieren, oder schmal, um die Spezifität zu optimieren und die Überlappung der Emissionskanäle zu reduzieren. Die Tabelle weiter oben ist ein Beispiel für eine häufig verwendete Konfiguration eines Fluoreszenzmikroskops. Bitte befassen Sie sich mit den Laser- und Filterkonfigurationen Ihres Geräts, um die besten Fluorophor-konjugierten Antikörper für Ihr Immunfluoreszenz-ICC- oder IHC-Protokoll auszuwählen. Wissenschaftler aus dem Bereich der Mikroskopie sind bei der Planung von IF-Versuchen oft eine wertvolle Unterstützung.
Zusätzliche Überlegungen bei der Auswahl von Fluorophoren
Photostabilität: Photobleichung oder irreversible lichtinduzierte Schäden an Fluorophoren, die ihre Fluoreszenzfähigkeit beeinträchtigen, können durch Überbelichtung fluoreszierender Moleküle mit Umgebungslicht oder Anregung im Verlauf der Mikroskopie entstehen. Viele ubiquitäre Fluorophore wie FITC und TRITC sind weit verbreitet, weil sie nicht proprietär und bereits lange auf dem Markt sind. Aber sie können sehr viel empfindlicher auf Photobleiche reagieren als Fluorophore neuerer Generationen, in denen andere chemische Verfahren eingesetzt werden.
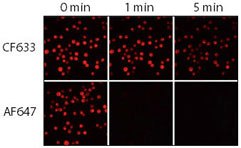
Abbildung 3.Relative Photostabilität der Konjugate CF633 und Alexa Fluor 647 (AF647) Ziege-Anti-Maus. Jurkat-Zellen wurden fixiert, permeabilisiert und mit Kaninchen-Anti-CD3 gefärbt, gefolgt von CF633- oder Alexa Fluor® 647 Ziege-Anti-Kaninchen IgG-Konjugaten. Die Proben wurden mit einem mit Quecksilberbogenlampenmikroskop, das mit einer Cy5-Filtereinheit und einer CCD-Kamera ausgestattet war, abgebildet. Sequenzielle Bilder wurden nach 0, 1 und 5 Minuten aufgenommen.
Bei der Herstellung verdünnter Antikörper-Gebrauchslösungen, die eine fluoreszierende Sonde enthalten, soll diese Gebrauchslösung in einem lichtundurchlässigen Behälter, z. B. einem Braunglasfläschchen, verdünnt werden. Gebrauchslösungen sind oft länger dem Licht ausgesetzt als gelagerte Stammlösungen oder kommerzielle Antikörperpräparate, sodass diese zusätzliche Maßnahme, mit der die Lichtexposition reduziert wird, in Anwendungsszenarien zusätzlichen Schutz bieten kann.
Programm zum Schutz der Fluoreszenz: Verlängern der Lebensdauer fluoreszierender Antikörper und Reagenzien
Fluoreszierende Reagenzien erfordern unter Umständen eine besondere Lagerung und Handhabung, um die Photostabilität der fluoreszierenden Einheit sowie die funktionelle Integrität des Antikörpers selbst zu erhalten. Es ist wichtig, sicherzustellen, dass das Reagenz unter den in den Versandpapieren des Lieferanten angegebenen Temperaturbedingungen eintrifft und in das vom Hersteller empfohlene Laborlager gebracht wird, damit die Licht- und Temperaturbedingungen nicht beeinträchtigt werden. Durch eine Aliquotierung des Antikörperbestands bei Ankunft in kleinere Volumina (mit wiederholter Markierung) wird die Integrität der Reagenzien geschützt, da die Stammlösung nicht so häufig einem Gefrier-/Auftauzyklus, den Schwankungen im Eisbehälter oder anderen Temperaturänderungen oder dem Umgebungslicht ausgesetzt wird.
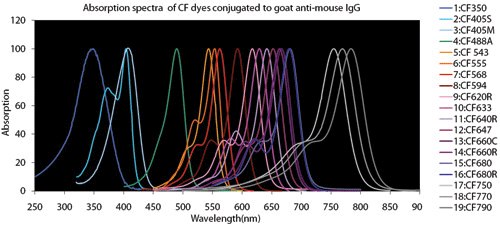
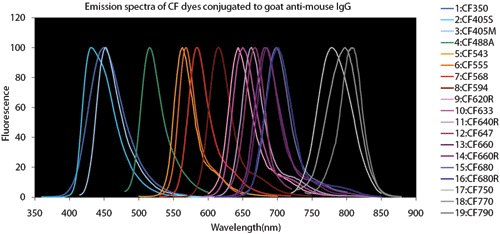
Abbildung 4.Vergleichsdiagramme Fluoreszenzfarbstoff
Überlappung von Spektren: Bei der Durchführung von multiplexen Versuchen zum Nachweis mehrerer Ziele in derselben Probe ist es wichtig, Augenmerk auf die spektralen Eigenschaften der Fluorophore, Laserwellenlängen und die Filterbereiche des Mikroskops zu legen. Mikroskopische Emissionsfilterkonfigurationen sollen so gewählt werden, dass die spektrale Überlappung reduziert wird. Dabei ist es eine gute Praxis, Fluorophore zu wählen, die keine langen Emissions-"Schwänze" haben, die in einen benachbarten Filterkanal überlaufen könnten.

Abbildung 5.Relative Fluoreszenz von CF543 und Alexa Fluor 546 (AF546) Ziege-Anti-Maus-Konjugaten in Abhängigkeit von der Anzahl der Farbstoffmoleküle pro Protein (Markierungsgrad).
Auswahl von Antikörpern: Färbetechnik
Auswahl von Antikörpern
Direktfärbung: Manche Forscher schätzen die Vorteile eines "direkten Färbeverfahrens", bei dem der primäre Antikörper direkt an ein Fluorophor konjugiert wird, da die Bindung und der Fluoreszenznachweis in einem einzelnen Schritt erfolgen und die Gesamtzeit für die Durchführung des IF-ICC-Protokolls reduziert wird. Direkte Konjugate erleichtern auch die Multiplex-Färbung mehrerer Ziele in derselben Probe, da keine Primärantikörper aus verschiedenen Wirten ausgewählt werden müssen, um Kreuzreaktivität zu vermeiden (weitere Informationen über Multiplex-IF-ICC finden Sie weiter unten).
Wird ein Primärantikörperkonjugat eingesetzt, ist es wichtig, diesen Schritt im Dunkeln durchzuführen, um das Fluorophor vor Photobleichung zu schützen. Nach der Inkubation mit dem Primärkonjugat kann das Protokoll sofort mit dem Waschen und Eindecken fortgesetzt werden. Es ist möglich, einen Antikörpercocktail einzusetzen, um mehrere Ziele in der Probe in einem einzelnen Schritt einzufärben.
Indirekte Färbemethode: Beim "indirekten" Immunnachweis folgt auf einen unmarkierten Primärantikörper, der für das Ziel spezifisch ist, ein mit einem Fluorophor konjugierter Sekundärantikörper, mit dem die Wirtsspezies des Primärantikörpers nachgewiesen wird. Diese Technik bietet den eindeutigen Vorteil der Signalamplifikation, da die Möglichkeit besteht, dass mehrere fluorophorhaltige Sekundärantikörper an den Primärantikörper binden, wodurch sich die Zahl der fluoreszierenden Moleküle an der Antigenstelle erhöht.
Beim gleichzeitigen Multiplex-Targeting mehrerer Antigene in derselben Probe sind zusätzliche Überlegungen bei der indirekten Nachweismethode erforderlich, die nachstehend erläutert werden.
Antikörperauswahl: zielgerichtet, spezifische Reaktivität
Primärantikörper:
Beim indirekten Nachweis werden Antikörper in einem Cocktail für Multiplex-Versuche sowohl bei der Primär- als auch bei der Sekundärinkubation eingesetzt. Daher ist es wichtig, für jedes Ziel Primärantikörper auszuwählen, die in einem anderen Wirt gezüchtet wurden. Dadurch wird sichergestellt, dass jeder konjugierte Antikörper im Sekundärcocktail an einen eindeutigen Primärantikörper in der Probe bindet. Werden keine eindeutigen Wirte für den jeweiligen Zielantikörper ausgewählt, führt dies zu nicht auswertbaren Färbeergebnissen. Nachstehend finden Sie ein Beispiel für einen Versuchsaufbau zum indirekten Multiplex-Nachweis:
Würden Forschende in diesem Beispiel stattdessen einen Kaninchen Anti-B-Primärantikörper wählen, würden sowohl Anti-A als auch Anti-B zum Ziel für das Anti-Kaninchen Sekundärkonjugat und beide Ziele A und B durch ein grünes Fluoreszenzsignal markiert werden.
Primärantikörper-Gewebe-Kreuzreaktivität: Bei der Auswahl von Antikörpern für die indirekte Färbung ist es empfehlenswert, keine primären Antikörper zu wählen, die im gleichen Wirt gezüchtet wurden, aus dem die Probe stammt. Verwenden Sie zum Beispiel keine Maus-Primärantikörper für Mausgewebe. Die anschließende Verwendung eines Anti-Maus-Sekundärantikörpers würde wahrscheinlich zu einer weitreichenden Bindung des Sekundärantikörpers direkt an das Gewebe führen, was eine erhebliche Hintergrundfärbung zur Folge hätte. Obwohl Kits verkauft werden, welche die Host-on-Self-Reaktivität blockieren sollen, ist es am sichersten, Host-on-Self bei der Auswahl von Primärantikörpern für indirekte Protokolle zu vermeiden. HINWEIS: Host-on-Self-Kreuzreaktivitäten sind im Allgemeinen kein Problem für direkte Färbeverfahren.
Sekundärantikörper:
Wie weiter oben erläutert (Antikörperauswahl: Färbetechnik, die indirekte Methode, siehe oben), ermöglicht die "indirekte" IF-ICC eine Signalamplifikation, da mehrere Sekundärantikörper an das Ziel gebundene Primärantikörper binden können. Indirekte IF-ICC ermöglicht es dem Labor aber auch, eine modulare Bibliothek von Sekundärantikörpern aufzubauen, die mit einer wachsenden Sammlung von Primärantikörpern kompatibel ist, sodass jedes Ziel jedem verfügbaren Mikroskop-Filterkanal zugeordnet werden kann.
Waschen:
Durch das Waschen nach jeder Anwendung eines Antikörpers oder einer anderen fluoreszierenden Sonde werden in der Probe vorhandene Antikörper mit geringerer Bindungsaffinität eliminiert und somit unspezifische Signale oder Kreuzreaktivität reduziert. Die Bedeutung des Waschschritts kann nicht hoch genug eingeschätzt werden. Ein Waschvorgang in PBS über einige Minuten mit mindestens zwei Pufferwechseln unterstützt dabei, ungebundene und lose gebundene Antikörper aus der Probe zu entfernen.
Längere Waschvorgänge führen möglicherweise nicht zu einer spürbaren Verringerung des Hintergrunds, sind aber im Allgemeinen nicht schädlich, solange sich die Probe durch die längere Verweildauer im Puffer nicht vom Objektträger oder Deckglas löst. Bei sehr kurzen Waschvorgängen mit weniger Wiederholungen kann es vorkommen, dass Antikörper, die nicht spezifisch an das Ziel gebunden sind, nicht wirksam entfernt werden, was zu einem schlechten Signal-Hintergrund-Verhältnis führen kann.
Nukleare Gegenfärbung und Eindeckung:
Viele Forschende, die im Bereich der IF-ICC arbeiten, möchten vielleicht ein fluoreszierendes Reagenz verwenden, durch das der Zellkern markiert wird, wie z. B. DAPI oder Hoechst. Da diese beiden Substanzen innerhalb von Sekunden nach Kontakt mit der DNA fluoreszieren, kann ein DAPI-haltiges Eindeckmedium verwendet werden, um Kernfärbung und Eindeckung in einem einzelnen Schritt zu erreichen. Hierdurch wird Zeit gespart, da keine separaten DAPI/Hoechst-Färbe- und Waschschritte erforderlich sind, und die Variabilität der Konzentration und die Inkubationszeit für die Kerngegenfärbung reduziert werden.
Alle Eindeckmittel unterstützen dabei, das Deckglas auf dem Objektträger zu fixieren und die Probe für die Mikroskopie zu konservieren, indem sie ein Austrocknen verhindern. Viele Eindeckmittel sind auch so formuliert, dass sie den Brechungsindex für die Mikroskopie optimieren, und können Mittel enthalten, durch die an die gefärbte Probe gebundene Fluorophore vor Photobleichung geschützt werden.
Versuchskontrollen in der IF-ICC
Wie bei anderen Versuchen auch, wird durch die Einbindung von Positiv- und Negativkontrollen das Vertrauen in die Empfindlichkeit und Spezifität der Fluoreszenz-ICC-Ergebnisse gestärkt.
Kontrollmöglichkeiten für IF-ICC-Versuche:
Weglassen des Primärantikörpers:
Eine einfache Kontrolle, die leicht in jeden ICC-Versuch aufgenommen werden kann. Bei dieser Kontrolle wird der Primärantikörper im primären Färbeschritt eines indirekten Immunnachweisprotokolls weggelassen. Dadurch wird aufgezeigt, ob ein beobachtetes Signal auf eine unspezifische Bindung des fluoreszierenden Sekundärantikörpers direkt an die Probe zurückzuführen ist.
Isotypkontrolle:
Bei der direkten Färbung mit konjugierten Primärantikörpern hilft eine Probe, bei der das primäre Konjugat durch eine an dasselbe Fluorophor konjugierte Isotypkontrolle ersetzt wird, um sicherzustellen, dass jedes beobachtete Signal auf die Spezifität des Primärantikörpers für das Antigen zurückzuführen ist. Isotypkontrollen sind häufig beim Lieferanten des Antikörperkonjugats erhältlich und gehören zur gleichen Klasse und zum gleichen Immunglobulintyp wie der Antikörper gegen das Antigen, haben aber keine Spezifität für ein bekanntes Epitop. Die Isotypen dienen als Kontrolle für den Primärantikörper, da ihre Einbeziehung zeigt, dass das beobachtete Signal nicht auf die bloße "Klebrigkeit" des Primärantikörperproteins selbst zurückzuführen ist.
Zellen, die negativ auf das Zielantigen wirken:
Ein Zelltyp, von dem bekannt ist, dass er das Zielantigen nicht exprimiert, kann als negative Kontrollprobe dienen. Alternativ dazu sind Zellen, bei denen das Zielprotein genetisch so verändert wurde, dass es nicht exprimiert wird (Knockout-Zellen), eine robuste Kontrolle für die Zielspezifität, sofern sie verfügbar sind. Genetische Modifikationstechniken wie CRISPR/Cas-Nuklease können verwendet werden, um die Expression des Zielproteins auszuschalten, um eine negative Kontrollzelllinie zu erzeugen.
Zellen, die positiv auf das Zielantigen wirken:
Stehen Zellen zur Verfügung, die das betreffende Antigen nachweislich exprimieren, entweder endogen oder durch Modifikation, um ein Knock-in oder eine Überexpression des Gens zu erzeugen, so können diese als positive Kontrolle dienen, um zu bestätigen, dass das Färbeprotokoll ein Signal erzeugt, wenn das Ziel in der Probe vorhanden ist.
Insider-Tipps für ein optimales Signal und die Überwindung des Hintergrunds mit IF-ICC
- Nach Möglichkeit Antikörper auswählen, zu denen Daten vorliegen, die Ergebnisse bei ICC-Anwendungen belegen
- Spektrale Eigenschaften fluoreszierender Antikörper an Mikroskoplaser und -filter anpassen
- Zellproben fixieren, die gesund, frei von Verunreinigungen und Ausfällungen und subkonfluent sind
- Die optimale Fixierungs- und Permeabilisierungsmethode hängt vom Ziel und seiner subzellulären Lage ab
- Antikörper in Blockierungspuffer verdünnen, um die Blockierung während des gesamten Färbeprotokolls aufrechtzuerhalten
- Ein indirekter Nachweis mit einem fluoreszierenden Sekundärantikörper ermöglicht eine Signalamplifikation
- Bei der Auswahl von Antikörperkonjugaten mit ähnlichen spektralen Eigenschaften das stabilere Fluorophor auswählen, um eine Photobleichung bei langen oder wiederholten Mikroskopaufnahmen zu vermeiden und spektrale Überschneidungen zu vermeiden
- Immer geeignete Färbekontrollen hinzufügen. Positive und negative biologische Kontrollen verwenden, sofern verfügbar.
Literatur
Um weiterzulesen, melden Sie sich bitte an oder erstellen ein Konto.
Sie haben kein Konto?