MABN10
Anti-Amyloid-β-Antikörper, Klon W0-2
clone WO2, from mouse
Synonym(e):
Alzheimer disease, Alzheimer disease amyloid protein, Cerebral vascular amyloid peptide, Protease nexin-II, amyloid beta (A4) precursor protein, amyloid beta A4 protein, amyloid beta precursor protein, beta-amyloid peptide, human mRNA for amyloid A4 prec
About This Item
Empfohlene Produkte
Biologische Quelle
mouse
Qualitätsniveau
Antikörperform
purified immunoglobulin
Klon
WO2, monoclonal
Speziesreaktivität
mouse, human
Methode(n)
ELISA: suitable
immunohistochemistry: suitable (paraffin)
western blot: suitable
Isotyp
IgG2aκ
NCBI-Hinterlegungsnummer
UniProt-Hinterlegungsnummer
Versandbedingung
wet ice
Posttranslationale Modifikation Target
unmodified
Angaben zum Gen
human ... APP(351)
Allgemeine Beschreibung
Spezifität
Immunogen
Anwendung
Neurowissenschaft
Neurodegenerative Erkrankungen
Qualität
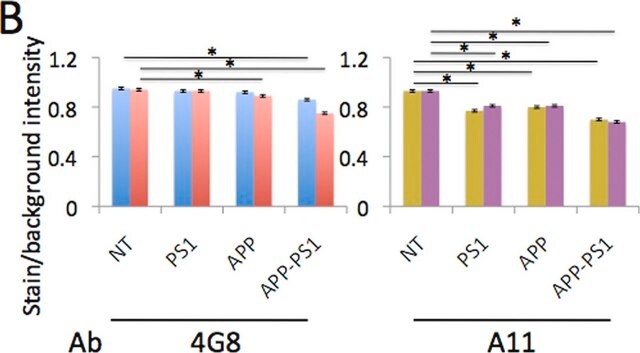
Western-Blot-Analyse: Mit 0,5 µg/ml dieses Antikörpers wurde Amyloid β in 10 µg humanem Hirngewebelysat von Alzheimer-Patienten nachgewiesen.
Zielbeschreibung
Verlinkung
Physikalische Form
Lagerung und Haltbarkeit
Hinweis zur Analyse
Humanes Hirngewebelysat von Alzheimer-Patienten
Sonstige Hinweise
Haftungsausschluss
Empfehlung
Lagerklassenschlüssel
12 - Non Combustible Liquids
WGK
WGK 1
Flammpunkt (°F)
Not applicable
Flammpunkt (°C)
Not applicable
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.