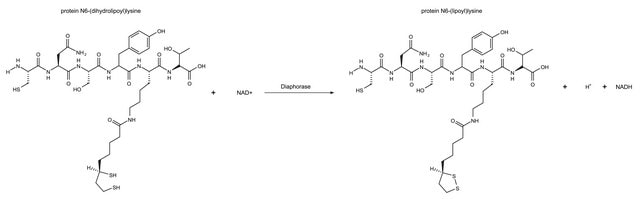
Des plateformes de nanoparticules (PN) de polyacrylamide contenant du bleu de méthylène (BM) ont été testées en solution avec de la diaphorase de
Clostridium kluyveri et le cofacteur NADH. Ce test visait à vérifier si l′encapsulation du BM dans des PN pouvait empêcher sa réduction et ainsi protéger son efficacité photodynamique.
[1] L′enzyme proposée par Sigma a été utilisée conjointement avec l′aldéhyde déshydrogénase pour construire un biocapteur de l′acétaldéhyde par immobilisation.
[2] Elle a également été employée dans la réoxydation du NADP en NADPH. Cette réaction a permis simultanément de catalyser la conversion de la résazurine en résorufine, un composé à forte fluorescence, et de détecter des quantités infinitésimales de NAADP. Le NAADP a d′abord été converti en NADP et NADPH par d′autres enzymes.
[3]La diaphorase de Clostridium kluyveri, ou lipoyl déshydrogénase, a été utilisée dans une étude visant à évaluer les interactions protéine-protéine dans l′assemblage de l′acide lipoïque sur les 2-oxoacide déshydrogénases du métabolisme aérobie. La lipoyl déshydrogénase a également été employée dans une étude destinée à investiguer la régulation redox de la nitration de la tyrosine et de la réduction de la 3-nitrotyrosine par des antioxydants.