MABN389
Anticorps anti-α-synucléine agrégée, clone 5G4
clone 5G4, from mouse, purified by affinity chromatography
Synonyme(s) :
Aggregated a-synuclein, Alpha-synuclein, Non-A beta component of AD amyloid, Non-A4 component of amyloid precursor, NACP
About This Item
Produits recommandés
Source biologique
mouse
Niveau de qualité
Forme d'anticorps
affinity purified immunoglobulin
Type de produit anticorps
primary antibodies
Clone
5G4, monoclonal
Produit purifié par
affinity chromatography
Espèces réactives
human
Technique(s)
ELISA: suitable
immunohistochemistry: suitable
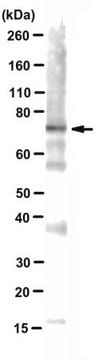
western blot: suitable
Isotype
IgG1κ
Numéro d'accès NCBI
Numéro d'accès UniProt
Conditions d'expédition
dry ice
Modification post-traductionnelle de la cible
unmodified
Informations sur le gène
human ... SNCA(6622)
Catégories apparentées
Description générale
Des expériences de cartographie des épitopes Pepscan ont montré que l'épitope du 5G4 semble être caché à l'intérieur de l'α-synucléine complète en solution aqueuse et que cela pourrait dépendre d'une conformation spécifique de la molécule. Ainsi, après un changement de conformation comme la formation de feuillets β, la structure de liaison du 5G4 peut être accessible dans les échantillons biologiques.
Cet anticorps peut former une paire d'anticorps pour les tests ELISA en sandwich avec l'anticorps anti-α-synucléine, clone 10D2, réf. MABN633.
Immunogène
Application
Analyse ELISA : un lot représentatif provenant d'un laboratoire indépendant a permis de détecter l'α-synucléine agrégée dans un test ELISA en sandwich avec l'anticorps anti-α-synucléine, clone 5G4, réf. MABN633 (Kovacs, G. G., et al. (2012). Acta Neuropathol. 123(1):37-50).
Neurosciences
Maladies neurodégénératives
Qualité
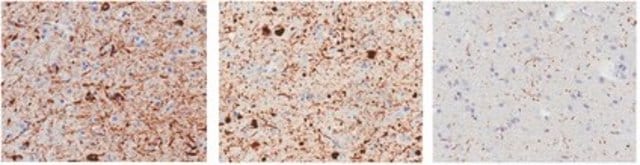
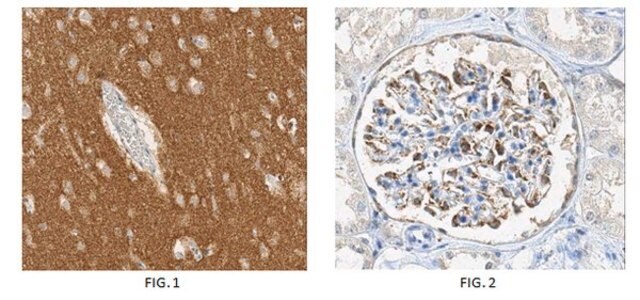
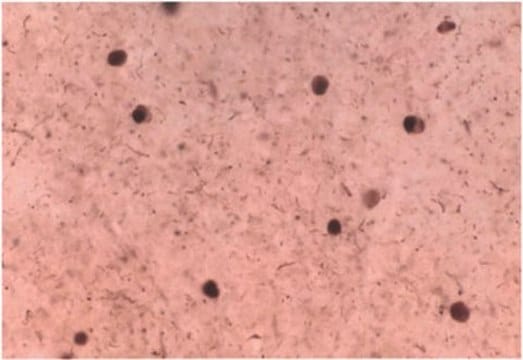
Analyse par immunohistochimie : un lot représentatif a permis de détecter l'α-synucléine agrégée dans le tissu cérébral d'un patient atteint de la maladie de Parkinson.
Description de la cible
Forme physique
Stockage et stabilité
Recommandations relatives à la manipulation du produit : dès réception, et avant le retrait du bouchon, centrifuger le flacon et mélanger délicatement la solution. Répartir en aliquotes dans des microtubes à centrifuger et conserver ces derniers à -20 °C. Éviter les congélations/décongélations répétées, qui peuvent détériorer les IgG et nuire aux performances du produit.
Autres remarques
Clause de non-responsabilité
Vous ne trouvez pas le bon produit ?
Essayez notre Outil de sélection de produits.
En option
Code de la classe de stockage
12 - Non Combustible Liquids
Classe de danger pour l'eau (WGK)
WGK 2
Point d'éclair (°F)
Not applicable
Point d'éclair (°C)
Not applicable
Certificats d'analyse (COA)
Recherchez un Certificats d'analyse (COA) en saisissant le numéro de lot du produit. Les numéros de lot figurent sur l'étiquette du produit après les mots "Lot" ou "Batch".
Déjà en possession de ce produit ?
Retrouvez la documentation relative aux produits que vous avez récemment achetés dans la Bibliothèque de documents.
Notre équipe de scientifiques dispose d'une expérience dans tous les secteurs de la recherche, notamment en sciences de la vie, science des matériaux, synthèse chimique, chromatographie, analyse et dans de nombreux autres domaines..
Contacter notre Service technique