19924
Pyroglutamate Aminopeptidase from Pyrococcus furiosus, recombinant from E. coli
7-13 mU (per vial)
Synonyme(s) :
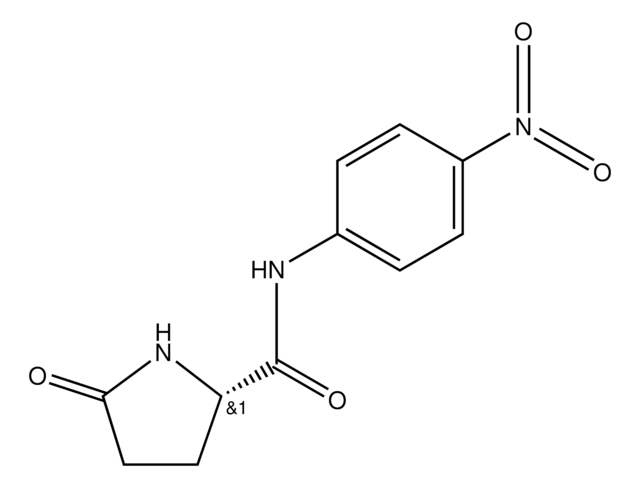
Pyrase, Pyroglutamyl-Peptidase I, Pyrrolidone Carboxyl Peptidase
About This Item
Produits recommandés
Produit recombinant
expressed in E. coli
Forme
lyophilized
Activité spécifique
7-13 mU (per vial)
Poids mol.
Mr ~28000
Température de stockage
−20°C
Catégories apparentées
Conditionnement
Définition de l'unité
Remarque sur l'analyse
Autres remarques
Mention d'avertissement
Danger
Mentions de danger
Conseils de prudence
Classification des risques
Eye Irrit. 2 - Resp. Sens. 1 - Skin Irrit. 2 - STOT SE 3
Organes cibles
Respiratory system
Code de la classe de stockage
11 - Combustible Solids
Classe de danger pour l'eau (WGK)
WGK 3
Point d'éclair (°F)
Not applicable
Point d'éclair (°C)
Not applicable
Certificats d'analyse (COA)
Recherchez un Certificats d'analyse (COA) en saisissant le numéro de lot du produit. Les numéros de lot figurent sur l'étiquette du produit après les mots "Lot" ou "Batch".
Déjà en possession de ce produit ?
Retrouvez la documentation relative aux produits que vous avez récemment achetés dans la Bibliothèque de documents.
Notre équipe de scientifiques dispose d'une expérience dans tous les secteurs de la recherche, notamment en sciences de la vie, science des matériaux, synthèse chimique, chromatographie, analyse et dans de nombreux autres domaines..
Contacter notre Service technique