Preclínica

Los ensayos preclínicos sirven para establecer que el compuesto diana demuestra la inocuidad y la eficacia necesarias para avanzar a ensayos en humanos. En esta etapa, las pruebas in vitro e in vivo pueden requerir varios años y, si tienen éxito, llevan a la preparación y presentación de una solicitud de nuevo fármaco en fase de investigación (IND).
Recursos biotecnológicos
- FDA Investigational New Drug (IND) Application
Explore FDA’s guidance on IND applications, a crucial step in drug development for biotech startups. Navigate regulatory intricacies efficiently.
- Emerging BioTalk Blog
Your gateway to the latest news in biotech. Dive into discussions on market trends, bioprocessing, and technologies for novel modalities. Join the discussion today.
- Brochure: Integrated Bioprocess Solutions
Navigate the path to commercialization with our comprehensive guide for Biopharmaceutical Startups. Accelerate your journey with our range of tools and services.
- Biopharmaceutical Application Guide
Navigate the biopharmaceutical landscape with our application guide, providing resources and solutions for mAb, ADC, and mRNA processes.
Los servicios de análisis toxicológicos son de vital importancia. Se requiere un amplio espectro de pruebas toxicológicas in vitro e in vivo, que deben diseñarse de acuerdo con las directrices internacionales y llevarse a cabo en estricto cumplimiento de la normativa sobre buenas prácticas de laboratorio (GLP).
Consideraciones sobre el desarrollo de procesos
- Desarrollo de líneas celulares
- Selección de clones
- Cribado de medios y nutrientes
- Desarrollo de los procesos anteriores
- Establecimiento de un banco de células maestras
- Desarrollo de las fases iniciales de los procesos
- Desarrollo de la formulación
- Desarrollo y optimización de métodos analíticos
- Apoyo al desarrollo de procesos analíticos
- Programas analíticos de comparabilidad de biosimilares
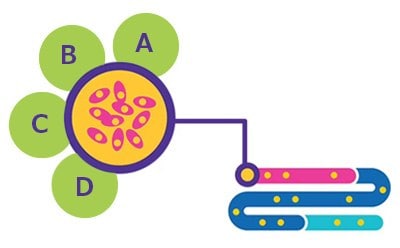
Figura 1.Desarrollo de líneas celulares. A. Caracterización del producto BioReliance®. B. Elaboración y conservación de bancos celulares BioReliance®. C. Desarrollo de líneas celulares BioReliance®. D. Caracterización de la líneas celulares BioReliance®.
Consideraciones sobre el desarrollo de las líneas celulares
- Elección del clone: líneas celulares que pueden producir el biofármaco a una concentración y calidad suficientes
- Estudios de robustez: estudios que replican las condiciones de escalado
- Estabilidad genética: la producción y la calidad de las proteínas deben permanecer estables después de > 60 generaciones de células
Consideraciones sobre el desarrollo de procesos
- Eficiencia de los procesos: eliminación de pasos inútiles y utilización de la capacidad
- Viabilidad del proceso: reproducibilidad en el escalado y la transferencia de tecnología
- Viabilidad financiera: equilibrio entre productividad y coste

Consideraciones tecnológicas
- Flexibilidad: el equipo de un solo uso mejora la flexibilidad, la elaboración de plantillas y la configuración rápida del conjunto, y reduce los costes de limpieza
- Escalabilidad al elegir las tecnologías en las primeras etapas, como el escalado del biorreactor utilizado para el cultivo de células de mamífero de 3 l a 200 l y a 2 000 l.
- Facilidad de uso: las soluciones incluyen rutas de flujo de procesos estériles premontadas; conectores que permiten conexión, desconexión y reconexión asépticas
Consideraciones normativas
- Seguridad: los hitos del desarrollo clínico deben evaluar la inocuidad y la eficacia del producto
- Calidad del producto y robustez del proceso: deben confirmarse la recopilación y el análisis de los datos
- Estrategia de solicitud de aprobación: conocer los países en los que se presentará la solicitud de autorización debe guiar a quién inspecciona la instalación de fabricación
Consideraciones comerciales
- Rapidez en llegar a la clínica: se están realizando grandes inversiones en investigación y desarrollo sin retorno
- Eficiencia del proceso: consideración proactiva del escalado, no solo la velocidad inicial
- Estrategia de solicitud de aprobación: identificar el país para presentar las solicitudes en primer lugar y obtener acceso rápido al mercado
El acceso a los recursos adecuados le ayuda a concentrarse en los descubrimientos con el mayor potencial para ayudar a los pacientes necesitados. Seleccione su etapa del proceso de desarrollo para obtener más información o siga los enlaces de productos y servicios para obtener recursos.
Secuencia de trabajo de los recursos del centro biotecnológico


Descubrimiento
Identificación de las consideraciones, los recursos y el apoyo que necesita para desarrollar un nuevo biofármaco candidato

Fase I-II
Aceleración del desarrollo de sus procesos con consejos, plantillas y guías de aplicación

Fase III y fabricación
Avance desde el escalado y la transferencia de tecnología hasta la producción de calidad para los ensayos y la comercialización

Programas de activación
Conexión con recursos y programas de subvenciones que puedan desbloquear el potencial de su molécula

Normativa
La navegación por una de las industrias más reguladas del mundo comienza con una guía de confianza
Para seguir leyendo, inicie sesión o cree una cuenta.
¿No tiene una cuenta?



