MABN826
Anticorps anti-phospho-α-synucléine (Ser129), clone 81A
clone 81A, from mouse
Synonyme(s) :
Alpha-synuclein, NACP, Non-A beta component of AD amyloid, Non-A4 component of amyloid precursor, Synuclein alpha-140
About This Item
Produits recommandés
Source biologique
mouse
Niveau de qualité
Forme d'anticorps
purified antibody
Type de produit anticorps
primary antibodies
Clone
81A, monoclonal
Espèces réactives
mouse, human
Technique(s)
electron microscopy: suitable
immunocytochemistry: suitable
immunofluorescence: suitable
immunohistochemistry: suitable (paraffin)
western blot: suitable
Isotype
IgG2aκ
Numéro d'accès NCBI
Numéro d'accès UniProt
Conditions d'expédition
dry ice
Modification post-traductionnelle de la cible
phosphorylation (pSer129)
Informations sur le gène
human ... SNCA(6622)
Catégories apparentées
Description générale
Spécificité
Immunogène
Application
Neurosciences
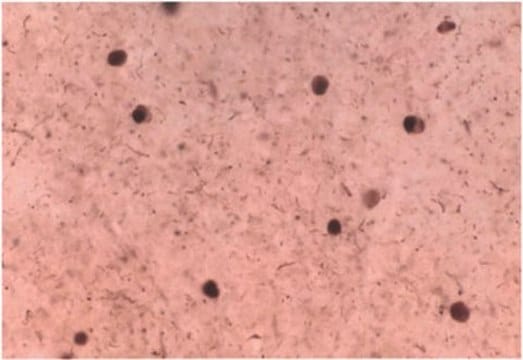
Immunocytochemistry Analysis: A representative lot detected Ser129-phosphorylated α-synuclein in Lewy bodies-/LB- and Lewy-neurite-/LN-like inclusions in cultured embryonic hippocampal neurons from wild-type mice and mice carrying human mutant P301S tau transgene, but not Snca-/- mice, upon exposure to preformed α-synuclein fibrils (pffs) from C-terminally truncated, Myc-tagged α-synuclein (Guo, J.L., and Giasson, B.I. (2013). Cell. 154(1):103-117).
Electron Microscopy Analysis: A representative lot detected phosphorylated α-synuclein in close physical associations of tau in filamentous structures within neuronal processes of human P301S mutant tau transgenic mouse embryo hippocampal neurons exposed to α-synuclein fibrils formed by repeated rounds of self-seeding using C-terminally truncated, Myc-tagged α-synuclein (Guo, J.L., and Giasson, B.I. (2013). Cell. 154(1):103-117).
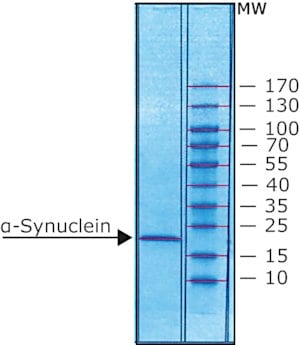
Western Blotting Analysis: A representative lot detected phosphorylation of the Triton-insoluble α-synuclein formed in cultured mouse embryonic hippocampal neurons upon exposure to preformed α-synuclein fibrils (pffs) from C-terminally truncated, Myc-tagged α-synuclein (Guo, J.L., and Giasson, B.I. (2013). Cell. 154(1):103-117).
Western Blotting Analysis: A representative lot detected Ser129 phosphorylation of Triton-insoluble, but not Triton-soluble, α-synuclein in the cingulate cortex extracts from DLB (dementia with Lewy bodies) patients and the cerebella extracts from patients with multiple systems atrophy (MSA) (Waxman, E.A., et al. (2008). J. Neuropathol. Exp. Neurol. 67(5):402-416).
Western Blotting Analysis: A representative lot detected CK1- and CK2-catalyzed alpha-synuclein Ser129 phosphorylation, but not CK1-catalyzed α-synuclein Ser87 phosphorylation, nor non-phosphorylated α-synuclein (Waxman, E.A., et al. (2008). J. Neuropathol. Exp. Neurol. 67(5):402-416).
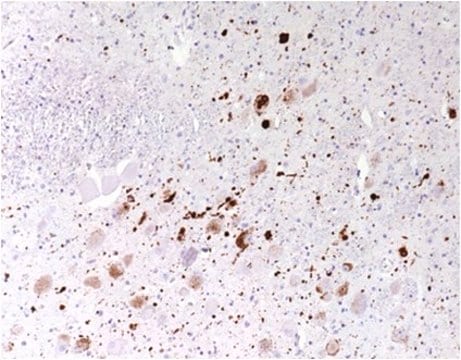
Immunohistochemistry Analysis: A representative lot detected pathologic inclusions-associated α-synuclein Ser129 phosphorylation in paraffin-embedded brain tissue sections from patients with PD (Parkinson′s disease), DLB (dementia with Lewy bodies) and MSA (multiple systems atrophy), while clone 81A detected no α-synuclein Ser129 phosphorylation associated with neurofibrillary tangles in the hippocampus of a patient with Alzheimer′s disease (Waxman, E.A., et al. (2008). J. Neuropathol. Exp. Neurol. 67(5):402-416).
Immunofluorescence Analysis: A representative lot detected pathologic inclusions-associated α-synuclein Ser129 phosphorylation by fluorescent immunohistochemistry in paraffin-embedded cingulate cortex sections from a patient with LB variant of Alzheimer′s disease (LBVAD) and in the cerebellum sections from a patient with multiple systems atrophy (MSA) (Waxman, E.A., et al. (2008). J. Neuropathol. Exp. Neurol. 67(5):402-416).
Note: Incubating the transferred membrane with a combination of 4% paraformaldehyde and 0.01 ~ 0.1% glutaraldehyde is reported to produce an approximately 10-fold increase in the detection sensitivity of α-synuclein Ser129 phosphorylation by Western blotting. If not fixed, α-synuclein monomers can detach from the transferred membrane during incubation (Sasaki, A., et al. (2015). Sci. Rep. 5:14211).
Maladies neurodégénératives
Qualité
Analyse par isotypage : L'identité de cet anticorps monoclonal est confirmée par isotypage comme étant de l'IgG2aκ.
Description de la cible
Forme physique
Stockage et stabilité
Autres remarques
Clause de non-responsabilité
Vous ne trouvez pas le bon produit ?
Essayez notre Outil de sélection de produits.
Code de la classe de stockage
12 - Non Combustible Liquids
Classe de danger pour l'eau (WGK)
WGK 1
Point d'éclair (°F)
Not applicable
Point d'éclair (°C)
Not applicable
Certificats d'analyse (COA)
Recherchez un Certificats d'analyse (COA) en saisissant le numéro de lot du produit. Les numéros de lot figurent sur l'étiquette du produit après les mots "Lot" ou "Batch".
Déjà en possession de ce produit ?
Retrouvez la documentation relative aux produits que vous avez récemment achetés dans la Bibliothèque de documents.
Notre équipe de scientifiques dispose d'une expérience dans tous les secteurs de la recherche, notamment en sciences de la vie, science des matériaux, synthèse chimique, chromatographie, analyse et dans de nombreux autres domaines..
Contacter notre Service technique