MABN821
Anticorps anti-protéines à polyQ pathologique, clone 3B5H10
clone 3B5H10, from mouse
Synonyme(s) :
Huntingtin mutants with expanded polyQ repeats, HD protein, Huntington disease protein, mHtt, PolyQ disease proteins
About This Item
Produits recommandés
Source biologique
mouse
Niveau de qualité
Forme d'anticorps
purified antibody
Type de produit anticorps
primary antibodies
Clone
3B5H10, monoclonal
Espèces réactives
human
Technique(s)
electron microscopy: suitable
immunocytochemistry: suitable
immunohistochemistry: suitable
inhibition assay: suitable
western blot: suitable
Isotype
IgG1
Numéro d'accès UniProt
Conditions d'expédition
ambient
Modification post-traductionnelle de la cible
unmodified
Informations sur le gène
human ... HTT(3064)
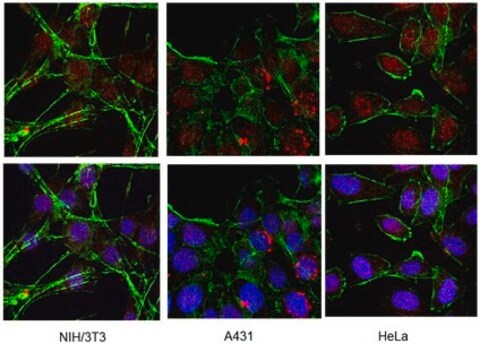
Description générale
Spécificité
Immunogène
Application
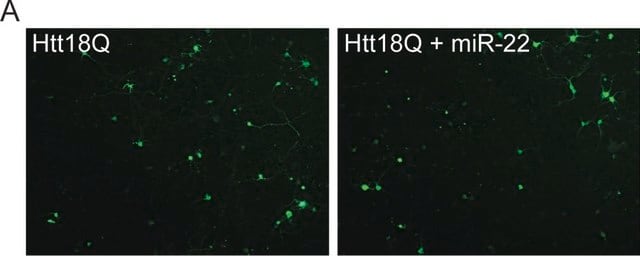
Analyse par immunocytochimie : Un lot représentatif a permis d'immunomarquer des neurones exprimant de façon transitoire la Htt ou l'ataxine-3 présentant une expansion de polyQ pathologique (Q46 à Q138), mais pas des neurones exprimant la Htt du type Q17 ou l'ataxine-3 du type Q27. Le clone 3B5H10 a permis de marquer la Htt mutante (Httm) diffuse, mais pas la Htt agrégée dans les grands corps d'inclusion (Miller, J., et al. (2011). Nat. Chem. Biol. 7(12):925-934).
Analyse par immunohistochimie : Un lot représentatif a permis d'immunomarquer des coupes de tissus cérébraux issus de souris transgéniques exprimant des huntingtines mutantes (Httm) humaines pathologiques, notamment les souches murines BACHD (Httm complète du type Q97), R6/2 (fragment d'exon 1 du type ~Q150), et YAC-SCA3 (Httm complète du type Q84). Le clone 3B5H10 a permis de marquer la Htt diffuse mais n'est pas parvenu à marquer les tissus contenant de la Htt fortement agrégée, à moins d'effectuer un démasquage antigénique puissant par traitement à l'acide formique à 90 % (Miller, J., et al. (2011). Nat. Chem. Biol. 7(12):925-934).
Analyse d'inhibition : Un lot représentatif a empêché l'agrégation d'un fragment codé par l'exon 1 de la Htt mutante (Httm) du type Q39 ou Q53 et a dégradé in vitro des fibrilles et des oligomères de Httm pré-agrégée en monomères, comme le montrent les analyses par microscopie à force atomique (AFM) et diffusion dynamique de la lumière (DLS) (Miller, J., et al. (2011). Nat. Chem. Biol. 7(12):925-934).
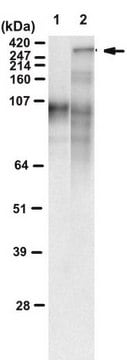
Analyse par western blotting : Un lot représentatif a permis de détecter des constructions de huntingtine (Htt), de récepteur des androgènes (AR) et d'atrophine comportant une expansion de polyQ pathologique (Q65 à Q103), mais pas de constructions du type Q19 ou Q25, exprimées par voie exogène dans des cellules HEK293 et PC12. Le clone 3B5H10 a permis de détecter des fragments N-terminaux de Httm monomère et peut-être de petits oligomères d'Httm, mais pas de gros oligomères ou d'agrégats de haut poids moléculaire (Miller, J., et al. (2011). Nat. Chem. Biol. 7(12):925-934).
Qualité
Analyse par western blotting : Une concentration de 0,5 µg/ml de cet anticorps a permis de détecter un fragment N-terminal de huntingtine codé par l'exon 1 présentant une expansion constituée de 134 glutamines/Gln (134Q), mais pas le fragment normal (de type sauvage) correspondant avec 17Q.
Description de la cible
Forme physique
Autres remarques
Vous ne trouvez pas le bon produit ?
Essayez notre Outil de sélection de produits.
En option
Code de la classe de stockage
12 - Non Combustible Liquids
Classe de danger pour l'eau (WGK)
WGK 1
Certificats d'analyse (COA)
Recherchez un Certificats d'analyse (COA) en saisissant le numéro de lot du produit. Les numéros de lot figurent sur l'étiquette du produit après les mots "Lot" ou "Batch".
Déjà en possession de ce produit ?
Retrouvez la documentation relative aux produits que vous avez récemment achetés dans la Bibliothèque de documents.
Notre équipe de scientifiques dispose d'une expérience dans tous les secteurs de la recherche, notamment en sciences de la vie, science des matériaux, synthèse chimique, chromatographie, analyse et dans de nombreux autres domaines..
Contacter notre Service technique