本文轉載自HistoLogic,第38卷第1期,2005.
。真菌染色的重要性
真菌染色仍然是組織學實驗室鑑定傳染性微生物的重要診斷工具。皮膚真菌病或涉及皮膚的表層真菌感染很少會造成嚴重的人體健康問題;然而,全身性真菌病如新變形隱球菌 和白色念珠菌 可造成危及生命的感染,尤其是在免疫抑制的人群中。因此,當 H&E 染色觀察到真菌感染的跡象時,手術病理學家通常會緊急要求進行真菌染色。
Schiff「s Reagent and Hexamine Silver Solutions
大多數的真菌都相當大,其菌壁富含多醣體 (1,2-glycol基團),可以用 Schiff」s Reagent 或 hexamine (methenamine) silver solution 來顯示。1 這兩種技術都仰賴使用氧化劑(週期性酸或鉻酸)來為席夫或銀離子製造醛結合位點。Grocott's silver (GMS) 染色法可能是應用最廣泛的真菌染色法,然而,即使是最有經驗的組織學醫師,也可能會因為銀染色的多變特性而受到挑戰。銀浸漬不足、過度染色導致高背景染色,或不理想的沉澱物,都可能造成尋找染色真菌生物的困難。
因此,有些病理學家會例行訂購週期性酸性-Schiff (PAS)染色,希望能達到快速且萬無一失的染色效果。這種方法是組織學實驗室最常使用的技術之一。它的操作相對簡單且可靠,即使是經驗不足的人也可以輕易上手。PAS 染色法可可靠地顯示大多數真菌的多醣壁,但莢膜組織原體 (Histoplasma capsulatum) 除外。2
多糖成分的意外染色
然而,使用 PAS 進行真菌染色的一個缺點是,無論多糖出現在組織中何處,都會被染色。這種方法可以染色來自各種動物品種的各種正常細胞中的許多細胞內成分。以下列出其中一些細胞內成分3:
- 糖原
- 中性黏液物質
- 一些上皮的磺黏蛋白和矽黏蛋白
- 甲狀腺的膠質
- 基底膜
- 網狀纖維
- 盤狀細胞顆粒
- 腎上腺嗜铬细胞
- 神經細胞糖脂
- 輸精管核內包涵物
- 腎動脈小動脈的纖維細胞
- 網狀內皮細胞內的粒
- 唾液腺
- 胃腺和布魯諾氏腺
當嘗試尋找 PAS 染色的真菌時,某些組織中含有這些元素可能會分散注意力。因此,使用 PAS 進行真菌染色的病理學家通常會要求使用 diastase 消化法進行染色,以嘗試減少對不感興趣或興趣不大的結構的染色。
染色劑中的氧化劑
有趣的是,很少有組織學從業人員質疑在 PAS 染色中使用氧化劑週期酸,但我們卻在真菌的 GMS 染色中使用氧化劑鉻酸。
事實上,如果我們在 GMS 染色中以週期酸取代鉻酸,基本上我們就會使用 Jones 的方法,它會特別染色基底膜和網狀纖維。
是的,Jones 的技術可以顯示真菌;然而,它也會染色許多其他結構,使得真菌生物的發現更加困難。無論我們使用的是希夫染色法或銀染色法,較弱的週期性酸性氧化劑都會在更多的組織結構中產生醛結合位點。在這個例子中,我們可以看到氧化劑的選擇如何能顯著決定哪些結構會被染色。
這些觀察結果其實在一兩代前就已相當知名。
這些觀察其實在一兩代以前就已經廣為人知,然而,這些較舊但仍然重要的資訊有時會被忽略。
Bauer (1933) 被認為是最早報告糖 (1,2-glycols) 與鉻酸氧化後會產生能結合 Schiff 分子的醛的人。4 其他許多人,包括 Hotchkiss、McManus (1960)、Spicer、Pearse 和 Lillie,都繼續使用各種氧化劑研究醛-席夫反應。
鉻酸和高錳酸鉀是比週期酸更強的氧化劑,它們也會在多醣體中產生醛,但如果給它們足夠的時間,它們會進一步攻擊並破壞這些醛。"由於醛會被鉻酸進一步氧化,因此醛反應的密度較低,而且 乙二醇基團較少的結構無法展現,例如基底膜、膠原纖維和網狀纖維。"5 Lillie的這句話告訴我們為什麼染色真菌時鉻酸是較好的氧化劑,因為這些生物的細胞壁有較高密度的糖(多醣體)。
儘管鉻酸會繼續進一步氧化所有的多醣體,但在濃度最高的區域完成轉換需要較長的時間,因此這些多醣體仍能與 Schiff(或銀)產生反應。2 由於真菌的壁特別富含 1,2-乙二醇基團,因此它們比組織切片中其他大多數的反應成分染色更強。真菌與背景之間的對比通常比 PAS 反應染色的複製切片更為明顯3 (圖1 及 2)。此討論顯示,如果真菌存在於您的組織切片中,使用較強的氧化劑(如鉻酸)時,真菌較不容易被遺漏:
Recommend: Chromic Acid followed by Schiff
我們實驗室的工作讓我們相信,使用鉻酸作為氧化劑,然後再使用 Schiff,可以產生比 PAS 更好的真菌染色結果,因為背景染色會大幅減少。這種方法與一般的 PAS 方法一樣簡單,但卻避免了進行雙酶切片的需要,因為雙酶切片會增加真菌染色的不必要工作和費用。Casella3 所報告的利用高錳酸鉀作為氧化劑的方法,是另一種替代週期性酸液的合適方法,在真菌染色時可得到與鉻酸相似的結果。
有趣的是,chromic acid-Schiff (CAS) 與 Gridley6 的方法非常相似,這在許多組織學書籍中都可以找到,除了 Gridley 的技術還需要在 Schiff 之後使用醛紫紅素。7 醛富強素作為一種醛,會佔據 Schiff 試劑中未參與的連結,因此可加強染色的深度。2 儘管我們已證實醛富沁確實會加強染色生物的深度,但我們推測 Gridley 方法目前並未被廣泛使用,因為醛富沁染色需要使用對苯二酚,而對苯二酚是一種受管制的物質,在某些實驗室要取得對苯二酚可能會有問題。
總而言之,下次當您的病理學家要求使用 PAS 檢查真菌時,我們建議您建議 CAS 是更好的替代方法。使用會在不想要的位置產生醛的氧化劑,然後再使用酵素嘗試消除這些醛是沒有意義的。最好一開始就避免產生。使用平行染色切片(一個用 PAS 染色,另一個用 CAS 染色)進行簡單的示範,即使是最持懷疑態度的觀察者也會信服。

圖 1. 陽性真菌對照。PAS 染色,400X
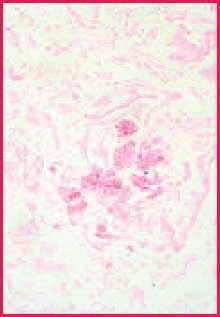
圖 2. 陽性真菌對照。鉻酸-希夫染色,400X
參考資料
若要繼續閱讀,請登入或建立帳戶。
還沒有帳戶?