A1153
Aprotinin
3-8 TIU/mg solid, lyophilized powder
Sinónimos:
BPTI, Inhibidor de la tripsina pancreática bovina, Inhibidor de tripsina (básico), Trasylol
About This Item
Productos recomendados
product name
Aprotinina from bovine lung, lyophilized powder, 3-8 TIU/mg solid
biological source
bovine lung
form
lyophilized powder
specific activity
3-8 TIU/mg solid
mol wt
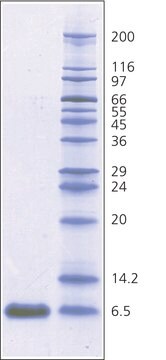
~6,500
solubility
H2O: ≥5 mg/mL
UniProt accession no.
storage temp.
2-8°C
InChI key
ZPNFWUPYTFPOJU-UHFFFAOYSA-N
Gene Information
cow ... PTI(404172)
¿Está buscando productos similares? Visita Guía de comparación de productos
General description
Application
- como un inhibidor de proteasas en el tampón de análisis mediante radioinmunoprecipitación (RIPA) para la homogeneización de las células endoteliales microvasculares cardiacas (CMEC)(4) y las células epiteliales de mamífero
- en el ensayo de angiogénesis para fibroblastos
- en la estabilización proteómica del sobrenadante de la saliva
Biochem/physiol Actions
Unit Definition
Preparation Note
also commonly purchased with this product
Storage Class
11 - Combustible Solids
wgk_germany
WGK 1
flash_point_f
Not applicable
flash_point_c
Not applicable
ppe
Eyeshields, Gloves, type N95 (US)
Certificados de análisis (COA)
Busque Certificados de análisis (COA) introduciendo el número de lote del producto. Los números de lote se encuentran en la etiqueta del producto después de las palabras «Lot» o «Batch»
¿Ya tiene este producto?
Encuentre la documentación para los productos que ha comprado recientemente en la Biblioteca de documentos.
Los clientes también vieron
Artículos
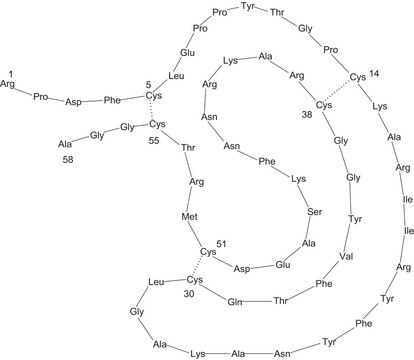
While aprotinin and bovine pancreatic trypsin inhibitor (BPTI) are the same protein sequence, the term aprotinin is typically used when describing the protein derived from bovine lung.
Elastase application index for understanding leukocyte elastase, a 29KDa serine endoprotease.
ReadyShield® phosphatase and protease inhibitor cocktail FAQ for sample protection in a variety of cell types and tissue extracts, including mammalian, plant, and microbial samples. Our ReadyShield® Protease Inhibitor Cocktail is a non-freezing solution that contains inhibitors with a broad specificity for serine, cysteine, acid proteases and aminopeptidases.
Analytical Enzyme Chymotrypsin: Chymotrypsin is produced in the acinar cells of the pancreas as the inactive precursor, chymotrypsinogen.
Protocolos
Objective: To standardize a procedure for the enzymatic assay of Aprotinin.
Nuestro equipo de científicos tiene experiencia en todas las áreas de investigación: Ciencias de la vida, Ciencia de los materiales, Síntesis química, Cromatografía, Analítica y muchas otras.
Póngase en contacto con el Servicio técnico