無菌試験は、医薬品、医療機器、その他の材料に対してcGMPで義務付けられている必須の微生物検査であり、製品が完全に無菌であり、安全に使用できることを確認するためのものです。無菌検査は、製品の品質管理と無菌性の保証のために極めて重要です。迅速無菌試験は、USP <71>、EP 2.6.1、および日本薬局方 4.06 無菌性試験の代替試験法であり、従来の無菌試験法と比較して培養時間を短縮し、結果を迅速に得ることができます。検査時間が短縮されることで、無菌製剤の迅速なリリースが可能になり、不具合が発生した場合の是正措置も迅速に対応できます。
Milliflex® Rapid システム 2.0 は理想的な迅速微生物代替法であり、従来の培養法との同等性が検証されています。本システムは、ATP生物発光技術を使用しており、生存可能な微生物を早期に検出することができます。
無菌試験での、Milliflex® Rapid システム 2.0
Milliflex®Rapidシステム2.0は、製造プロセス全体を通して、ろ過可能なサンプル中の生存可能な微生物汚染物質を迅速に検出、画像化、定量化する自動化ソリューションです。
本システムの成果は、工程管理、製品の歩留まり、最終製品のタイムリーなリリースを改善するのに役立ちます。万が一汚染が発生した場合、早期に是正措置を講じることができ、時間、費用、生産能力の損失を避けることができます。
迅速微生物検出システムの利点
Milliflex® Rapid システム 2.0 を使用することで、迅速な無菌検査が可能です。本システム 2.0による迅速無菌試験では、1サンプルあたり1 CFUまでの感度で、現在の培養法の3分の1の時間で微生物汚染を検出することができます。従来の無菌検査では、結果を出すのに少なくとも14日間の培養時間が必要です。培養を液体培地寒天培地に変更し、検査方法を目視検査から自動生物発光アッセイに変更することで、Milliflex® Rapid システム2.0は、結果が出るまでの期間をわずか5日間と大幅に短縮しました。本システムは、結果が出るまでの期間をわずか5日間に大幅に短縮します。
Milliflex® Rapid システム 2.0は、微生物汚染検査に大きなメリットをもたらします。
- 常に迅速で再現性のある結果
- メンブレンフィルター法や混釈培養法よりも最大4倍速い結果
- CFU数と従来法との相関性
- 21 CFR Part 11に準拠したソフトウェアによるデータの完全性
- 容易な取り扱いとバリデーション
Milliflex® Rapid システム のアプリケーション
Milliflex® Rapid システム 2.0は、バイオバーデンと無菌試験のニーズに最適な迅速ソリューションです。製薬業界、飲料業界、パーソナルケア業界など、ろ過可能な幅広いサンプルに対応:
- 原材料
- 無菌および非無菌最終製品
- 水のサンプル
- ミネラルウォーター、アイスティー、フレーバーウォーター、ビール、ワインなどの飲料水
- 細胞ベースのサンプル*
*アプリケーションサイエンティストにサポート・プロトコルの相談をする。
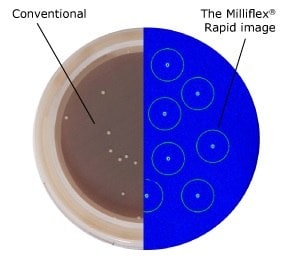
図1.6日後の従来法(左)と2日後のMilliflex®Rapidにより迅速検出した結果の比較。C. acnes type III、Schaeddler Blood Agar、35℃
メンブランフィルター法
今日のサンプル前処理の標準として、メンブランフィルター法は利用されています。一度に大量の製品を処理することができ、阻害物質を簡単に洗い流すことができます。この方法は、迅速なろ過と信頼性の高い結果を保証することにより、微生物の検出を最適化に役立ちます。
ATP生物発光
生きている細胞だけに存在するATPは、細胞の生存能力を示す優れた指標であす。生細胞と死細胞の両方を検出する他の方法とは異なり、ATP法は信頼性が高く、現行の検査法の検出率は同等です。
画像解析による微生物の定量化
Milliflex® Rapid システム 2.0は、相補型金属酸化膜半導体(CMOS)カメラを使用して、あらゆるマイクロコロニーを検出し、計数します。認識に必要なATP濃度は、代謝状態にもより異なりますが、カビ・酵母の細胞1個分、あるいはバクテリアの細胞約100個分に相当します。このカメラの感度は、最先端の画像解析と最適化された試薬と組み合わされ、マイクロコロニーの検出と定量に十分なATPを生成するのに必要な培養時間はわずかです。
サンプルの前処理、微生物の同定、マイクロコロニーの計数を含む微生物検査の完全なワークフローを以下に示します。
STEP 1
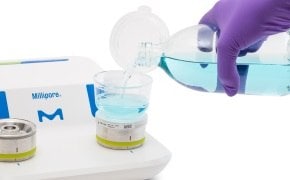
標準操作手順に従い、滅菌済みシングルユースのMilliflex Oasis® ろ過ユニットを用いて、サンプルを所定量をろ過します。メンブレンフィルターを Milliflex Oasis® 寒天プレートに貼り付け、培養します。Milliflex Oasis®メンブレンろ過システムの詳細をご覧ください。
STEP 2

メンブレンフィルターをMilliflex® Rapid 2.0 オートスプレーステーションにセットし、試薬を噴霧する。Milliflex® Rapid 2.0 AutoSpray Stationは、すべての生きた微生物に存在するATPを検出するために、2種類の試薬をフィルター表面全体に自動的に噴霧します。
STEP 3

メンブレンフィルターをMilliflex® Rapid システム 2.0 検出器にセットし、マイクロコロニー数を定量します。本システムは各微小コロニーをカウントし、ダウンロード、印刷、検索のためにデータを保存します。2分以内にサンプルが分析され、バッチ履歴とともに結果が表示されます。
Milliflex®Rapid法の規制コンプライアンス
Milliflex®で使用されているATP生物発光技術は、次のような代替検出方法として認められています。
- FDA1,2
- PDA Technical Report No. 33: Evaluation, Validation and Implementation of New Microbiological Testing Methods3
メンブランフィルター法は、微生物を捕捉するために米国、欧州、日本の規格で推奨されている方法です。Milliflex® Rapidシステム2.0は、国際光規格[LNE/NIST]に準拠しています。本システムは、国際光規格[LNE/NIST]で校正され、CEマークの電気適合性を満たしています。
21 CFR Part 11 準拠
Milliflex® Rapid System 2.0 ソフトウェアは FDA 規制 21 CFR Part 11 の電子記録に関する要件を満たしています。このソフトウェアの強力なバッチレポート機能には、電子署名、監査証跡の実行、データファイルの改ざん防止などの機能が含まれています。アクセスおよび編集権限は、ソフトウェア管理者モジュールによって制御され、21 CFR Part 11に準拠した安全なデータ取得および監査証跡を保証する。ソフトウェアのダウンロードはこちらから。
Milliflex® Rapid システムのサービス
技術サポートと包括的なサービスを利用することで、QCリソースを節約し、Milliflex®Rapid システム 2.0を日々の検に組み込むことができます。当社の経験豊富な専門家チームが、技術、機器、その他の技術サポートに関するお問い合わせに対応いたします。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?