(U)HPLCおよびLC-MSの性能の最適化におけるろ過の重要性
HPLCサンプルろ過用Millex®シリンジフィルター
移動相/溶媒ろ過用Millipore®メンブレンフィルターおよびフィルターホルダー
高品質のデータを得るためには適切なサンプル調製技術が重要であることはよく知られています。(U)HPLCやLC-MS分析前のサンプル調製ステップとしてろ過は省略されがちですが、サンプルや移動相に粒子が存在するとカラムや装置の性能を損なう可能性があるため、望ましくない結果をもたらすことがあります。私たちは、Millex®シリンジフィルターの粒子捕捉能を検討し、その結果を他のシリンジフィルターの結果と比較しました。次に、粒子捕捉効率(または捕捉率)をカラムの寿命と相関させました。ろ過済みサンプルと未ろ過サンプルをUHPLCシステムに注入し、最大500回の注入または設定圧力カットオフを超えるまで逆圧をモニタリングしました。また、移動相のろ過がカラムの逆圧に及ぼす影響も評価しました。これらのデータから、HPLCカラムの寿命を最適化するためにろ過が重要であることが示されています。
UHPLC、HPLC、LC-MSにおけるろ過
高性能、超高性能液体クロマトグラフィー(HPLC、UHPLC)および液体クロマトグラフィー-質量分析法(LC-MS)は、創薬および医薬品の品質管理、学術研究や政府調査、食品・飲料分析、臨床および環境試験において一般的な分析法です。最も簡単で安価なサンプル調製技術の1つがろ過であり、サンプルから粒子を除去します1。サンプル中の溶解しない粒子は低濃度であってもHPLCカラムを詰まらせ、装置の逆圧を高め、カラムの寿命を短縮するとともに、データ品質も低下させます2,3。ろ過を用いたサンプル中の粒子の除去によりこれらの問題を避けることが可能であり、より優れたクロマトグラフィーデータが得られる可能性もあります4。
ろ過は、(U)HPLCおよびLC-MSの移動相の調製でも重要です5,6,7 。市販のHPLC、UHPLC、LC-MS、MSグレードの溶媒はあらかじめろ過されており、これらの溶媒をボトルから直接出して移動相として使用する場合にはさらにろ過する必要はありません。しかし、移動相用に緩衝液および/または混合液を必要とする方法は多く、これらの方法ではリン酸塩や酢酸塩などの塩を添加する必要があります8。その場合、使用前に緩衝液をろ過し9、常に新鮮なものを使用する8ことが推奨されます。
さまざまなシリンジフィルターの捕捉効率を検討しました。 また、サンプルろ過の有無によるカラムの寿命も比較しました。
さまざまなシリンジフィルターの粒子捕捉率
捕捉率は、ろ過時にサンプルから除去することができる、またはフィルターを通過して装置に入る粒子の割合を示す指標です。粒子捕捉率を、4つの製造業者のシリンジフィルターを用いて評価しました。シリンジフィルターは、親水性ポリテトラフルオロエチレン(PTFE)または再生セルロース(RC)製です。0.05% (v/v) ビーズ水溶液のろ過後に、孔径0.45 μmのシリンジフィルターによる0.5 μm径ビーズの捕捉率および孔径0.2 μmのシリンジフィルターによる0.24 μm径ビーズの捕捉率を測定しました。1ロットあたり4個のシリンジフィルターにビーズ溶液を通過させました。多くの場合、複数のロットを試験しました。ビーズ溶液3 mLをろ過後にろ液を収集し、次に6点標準曲線と比較して蛍光または分光光度に基づき特性評価しました。
表1は、試験を行った4種類の0.45 μmシリンジフィルターの捕捉効率を示しています。捕捉効率は、メンブレンフィルターの材質によってさまざまであり、RCの捕捉率が最も低かった(48.2±4.3%)一方で、PTFEシリンジフィルターはポリスチレンビーズの約98~100%を捕捉することが示されました。
HPLCにおいて、孔径0.45 µmのフィルターメンブレンによるろ過で十分ですが、カラムに小さい粒子(例:2 µm未満の粒子、またはUHPLC)が充填されている場合には、0.2 μmのフィルターが必要です5,10。UHPLCカラムは、注入口のフリット、間隙スペース、チューブ径がより小さい傾向にあるため詰まりやすくなっています。このため、孔径0.2 μmシリンジフィルターによる0.24 μm径ビーズの捕捉率も評価しました(表2)。RCフィルターの捕捉効率は20%未満であり、ろ過すべき粒子の80%超がメンブレンを通過したことが示されました。3種類の親水性PTFEシリンジフィルターの捕捉効率はさまざまであり、全体としてMFR #2が最も低く、ロット間効率も一致しないことが示されました。
捕捉効率のデータから、同じ孔径等級のシリンジフィルターであってもサンプルろ過を等しく行えるわけではないことが示唆されました。
サンプルろ過の有無によるHPLCカラム寿命の評価
ろ過済みまたは未ろ過の0.05%(v/v)ビーズ溶液10 μLを反復注入することにより、カラムの寿命を評価しました。すでに試験を行った0.45 μmシリンジフィルター30個を用いてろ過を行い、HPLC用認証バイアル30個にろ液を入れました。大半の場合、複数のロットを試験しました。カラムへの注入最大500回まで、または設定した圧力カットオフ値8000 psiに達するまで、注入後に逆圧の変化をモニタリングしました。このカットオフは、システムが安全でない圧力レベルに到達しなかったことを確認できるように設定しました。HPLC条件を表3に示します。
0.45 μmシリンジフィルターによる検査ごとに新しいカラムを使用しました。チューブ、インジェクター、シール、HPLCシステムはすべて、カラム搭載と非搭載の両方で、試験と試験の間に十分洗浄し、前の試験の粒子がすべてシステムから除去されるようにしました。新しいカラムを搭載する際には、システムをアセトニトリルと水(70:30)で10分間フラッシュ(1 mL/min)した後、逆圧のベースライン値が安定するまで約10~15分間移動相(表3)で平衡化しました。
孔径0.45 μmのシリンジフィルターを用いて0.5 μm径ポリスチレンビーズの0.05%(v/v)溶液をろ過してHPLC用認証バイアルにろ液を入れました。次に、このろ液をUHPLC装置に注入しました。逆圧カットオフ(8000 psi)に到達または超えるまで、10 μLのみずつ反復注入しました。未ろ過サンプルも直接注入しました。その結果を図1に示します。
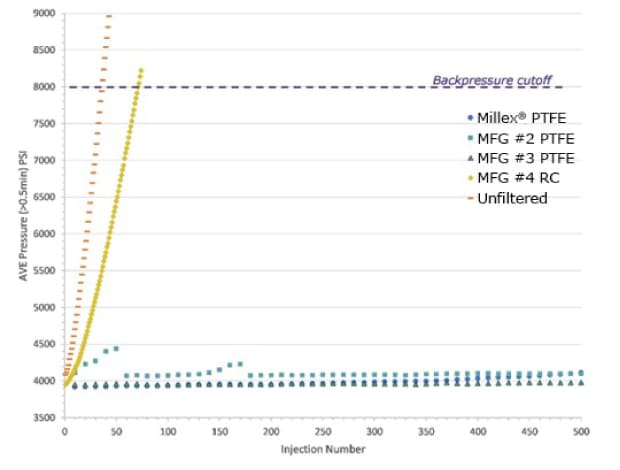
図1.UHPLCシステムの逆圧に対するサンプルろ過の影響。ろ過済みおよび未ろ過の0.5 μm径ビーズ0.05%(v/v)溶液の注入回数に対して平均逆圧(psi)をプロット。ろ過済みサンプルは、製造業者(MFR)の異なる孔径0.45 μmの親水性PTFEシリンジフィルター3種類およびRCシリンジフィルター1種類を通したものである。 未ろ過溶液も注入した。
逆圧のカットオフ値である8000 psiを超えるまでの未ろ過サンプルの注入回数はわずか36回でした。RCシリンジフィルターのろ液では、71回の注入後に逆圧がカットオフ値を超えました。このことは、粒子によって速やかにカラムが詰まり、10 μLの注入量でもカラムの寿命が大幅に短縮されることを示しています。この結果は、RCシリンジフィルターの溶液中の粒子捕捉率がわずか48%であった捕捉効率データと一致しており、RCシリンジフィルターでは、ろ過すべき粒子の約50%がろ過されずにUHPLCシステムに注入されていることを意味しています。PTFEを通してろ過されたサンプルは500回以上注入可能であり、カラムの逆圧に測定可能な変化が認められました。これは、すでに説明したとおり、粒子のほぼ100%がカラムで捕捉されたためでした。
移動相ろ過用のメンブレンフィルターの評価
(U)HPLCおよびLC-MS用途におけるろ過の重要性はサンプルろ過にとどまりません。移動相に粒子が存在しても、(U)HPLCに重大な問題が発生することがあります。Joshiらによる先行研究では、移動相からの粒子の除去が不完全である場合にもUHPLCカラムの逆圧の上昇が生じることが示されました(図2)7,11。この研究では、移動相をアセトニトリルと水(50:50)をポリプロピレン(PP)および親水性PTFEメンブレンフィルター(孔径0.2 μmおよび0.45 μm)でろ過しました。移動相を0.25 mL/分の流量でUHPLCカラムに流入させ、600分間にわたり逆圧をモニタリングしました。
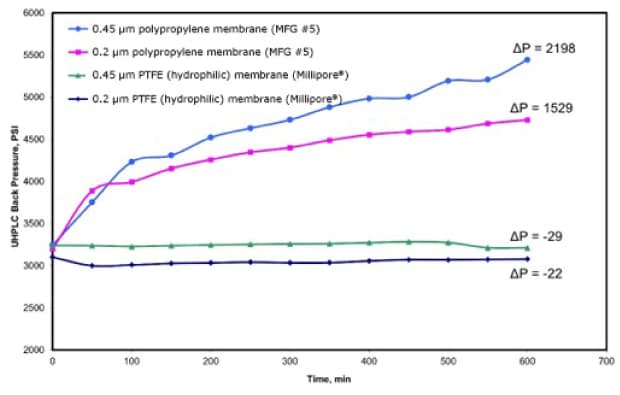
図2.0.25 mL/分での移動相の流入時間(分)に対するUHPLCシステム逆圧(psi)の変化(600分間)。移動相を孔径0.2 μmおよび0.45 μmポリプロピレン(PP)およびPTFEメンブレンによりろ過した。(参考文献11より許可を得て転載。 )
試験を行った4種類のメンブレンフィルターのうち、孔径0.45 μmおよび0.2 μmポリプロピレンメンブレンでろ過した移動相は、逆圧の上昇が最も大きいことが示されました。すでに考察した同じカラムに生じる問題は別にしても、移動相中の粒子はポンプチェックバルブ、ピストン、シールなどの装置部品の故障を早める可能性があります12。サンプル注入と比べて、移動相は実験中にカラムに接触する量が大幅に高く、粒子が存在すると、カラムの詰まりの影響が加速・悪化する可能性があります。
メンブレンフィルターの捕捉に影響を及ぼす因子
微孔性バリアとして機能するメンブレンフィルターを用いて、サンプルおよび移動相のろ過を実施しました。メンブレンの孔はバルクマトリックスから粒子を物理的大きさにより排除する役割を果たします。しかし、メンブレンの期待されるまたは公称の孔径よりも大きい粒子がメンブレンを通過したり、または小さい粒子が通過できなかったりと、状況によって捕捉結果が異なる場合があります。
形状、大きさ、頻度、分布、対称性などのマイクロフィルター孔のさまざまな特性が、そのフィルターが特定の大きさの粒子を捕捉するか否かを規定しています。このフィルター捕捉試験では、多様な製造業者の同じ孔径(特に孔径0.2 µm)のさまざまなPTFEフィルターにより、同じ粒子に対してさまざまな捕捉率が示されました。これは孔径分布と有孔性が製造業者間で異なるためであると考えられます。つまり、個々の孔径の最小から最大の範囲が大きく異なっている可能性があるのです。メンブレンの成形プロセスは、同じ材質であっても製造業者間で異なります。そのため作成される孔の形状は材質間で、時にはロット間で大きく異なります。特にプロセスが慎重に管理されていない場合、その傾向が強くなります。さらに、製造業者は、有孔性や孔径をさまざまな方法で測定しています。例えば、空気の透過性、バブルポイント、純水の透過性、BET分析、ポロメトリー、捕捉率などに基づいています。
シリンジフィルターを(U)HPLCやLC-MSのサンプル調製に使用する場合、粒子捕捉率は検討すべき唯一の特性ではありません。フィルターの化学的性質や化学的適合性、フィルター径、厚さ、ハウジングなど、その他のメンブレンの特性、およびろ過される溶液や分析対象物の化学的特性も全体的なメンブレンフィルターの性能に多大な影響を及ぼします13。
ろ過、カラムの詰まり、HPLC分析
(U)HPLC分析前にサンプルをろ過することは好ましいプラクティスといえます5。これにより、カラムの早すぎる詰まりや装置の逆圧の上昇が防止され、不要なシステムのシャットダウンやラボの生産性の低下を招くことなく、データ品質を維持することができます。捕捉効率試験の結果から、(U)HPLCでの注入前に粒子を含むサンプルをろ過するためにシリンジフィルターを用いる場合、そのカラム保護の仕組みや程度がさまざまである可能性が示唆されています。
同じ孔径等級のシリンジフィルターでも粒子捕捉効率は異なる可能性があるのです。(U)HPLCカラムを早すぎる詰まりから保護するためには、効率的に粒子を捕捉するフィルターを選択することが重要です。粒子はカラムの詰まりを引き起こすだけでなく、長期的には装置部品の故障ももたらす可能性があるため、移動相もろ過する必要があります。このように、HPLCカラムの寿命を守り、一貫した高品質のデータを作成するためには、サンプルと移動相の両方のろ過を常に考慮する必要があります。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?