Intensificación del proceso de AAV utilizando lisis con alta concentración salina y endonucleasas tolerantes a la sal
- Consideraciones relativas a la lisis celular
- Consideraciones relativas a la digestión del ADN
- Desarrollo de una endonucleasa tolerante a la sal para la producción de vectores AAV
- Selección de la Benzonase® adecuada para su aplicación
- Resolución del desafío de la elevada concentración salina
- Benzonase® preguntas frecuentes
- Deviron® preguntas frecuentes
La producción de vectores consistentes en virus adenoasociado (AAV) incluye un paso intermedio que combina la lisis celular y el tratamiento con nucleasas. Aquí, los detergentes se utilizan para romper la bicapa lipídica de las células, liberando los vectores, mientras que el ADN de la célula huésped y los plásmidos restantes se digieren con una endonucleasa para garantizar la seguridad del paciente y mejorar la eficiencia del proceso en las etapas posteriores. El ADN residual debe reducirse a menos de 10 ng/dosis y el tamaño del fragmento debe ser inferior a unas 200 pares de bases, como se recomienda en la Guía de la FDA para las solicitudes de nuevo producto en fase de investigación clínica de genoterapia de 2020.
En esta página se describen consideraciones fundamentales para la lisis celular y cómo se puede utilizar la combinación de una concentración salina elevada y una endonucleasa tolerante a la sal para aumentar la cantidad y la infectividad del vector.
Consideraciones relativas a la lisis celular
Aunque es aparentemente sencillo, el paso de lisis celular presenta varias dificultades. Los detergentes de uso común para lisar las células, como el TRITON™ X-100 (polietoxilato de 4 terc-octilfenol), pueden ser problemáticos. A partir de enero de 2021, la Comisión Europea prohibió el uso no autorizado de TRITON™ X-100 en la Unión Europea debido a su inclusión en el REACH (registro, evaluación, autorización y restricción de productos químicos). Esta inclusión, junto con las estrictas directrices relacionadas con su uso en la UE, se debe a los efectos sobre el sistema endocrino y mutágenos del producto de degradación del TRITON™ X-100, que según se ha determinado constituye un peligro para los pacientes y el medio ambiente.
Otras consideraciones que deben tenerse en cuenta al seleccionar un detergente para la lisis celular es que no debe dañar los vectores víricos ni la infectividad de las partículas víricas, y no debe interferir en los procesos consecutivos, lo que puede ocurrir con el uso de polisorbatos. El detergente seleccionado también debe ser modificable para su eliminación y detección en los pasos posteriores de la secuencia de trabajo.
Por último, es importante entender el impacto de la concentración salina en la lisis celular y el rendimiento del vector. Históricamente los tampones de lisis utilizados para la liberación de cápsides de AAV contenían una concentración fisiológica de sal (NaCl 150 mM). En publicaciones recientes, sin embargo, se ha comunicado que el aumento de la concentración de sal a 500 mM aumenta el número de partículas de vector y concentraciones infecciosas, y reduce la agregación de AAV. No obstante, como se describe más adelante, el alto contenido de sal puede afectar negativamente a la actividad de las endonucleasas convencionales utilizadas para la digestión del ADN en el proceso de fabricación de vectores de AAV.
Efecto de la elevada salinidad durante los pasos intermedios en la producción de AAV
Se realizó un estudio para determinar el impacto de una mayor concentración salina durante la lisis celular. Se produjeron vectores AAV5 en células HEK293 que habían sido lisadas con TRITON™ X-100, polisorbato 20, Deviron® C16 o Deviron® 13-S9. El número basal de cápsides producidas por un proceso se determinó utilizando NaCl 150mM en un tampón de lisis de polisorbato 20. El uso 500 mM de sal en el tampón de lisis indujo un aumento de la concentración de cápsides AAV5 en un promedio del 29 % (Figura 1).

Figura 1.Efecto de la lisis con elevada concentración salina en la producción de AAV5.
Efecto de la concentración salina elevada durante los pasos intermedios sobre la infectividad de los AAV
Para medir el efecto de las condiciones de NaCl 500 mM sobre la infectividad de los AAV, se realizó un estudio similar en el que se fabricaron vectores AAV2 en células HEK293. Las condiciones basales del tampón de lisis fueron NaCl 150 mM y polisorbato 20. Cuando la concentración de sal se incrementó a 500 mM y se utilizaron diferentes detergentes, se observó un aumento mínimo de diez veces de la infectividad (Figura 2). Como se señaló anteriormente, otro beneficio de usar una elevada concentración de sal durante la lisis es la reducción de la agregación de los AAV.
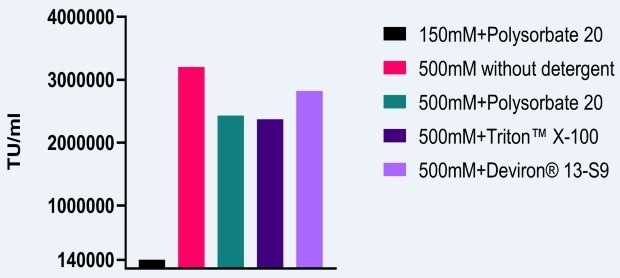
Figura 2.Efecto de la lisis con elevada concentración salina sobre la infectividad del AAV5.
Consideraciones relativas a la digestión del ADN
Igual que en el paso de lisis celular, la digestión del ADN también presenta varios desafíos. Entre los más importantes se encuentra la necesidad de obtener materiales con la calidad adecuada para cumplir con los requisitos normativos y garantizar la robustez de la cadena de suministro. Además de cumplir con las GMP, la pureza, el estado de glucosilación y la biocarga se encuentran entre los factores a considerar. La tolerancia de la enzima a una elevada salinidad también ha sido un factor crucial que impide el uso de elevadas concentraciones salinas durante la fabricación de AAV.
Criterios clave para la selección de enzimas en el proceso de fabricación de AAV
- IPEC PQG GMP o equivalente disponible, FDA DMF/BBMF
- Producto purificado > 99 %
- Ausencia de modificaciones postraduccionales
- Análisis de presencia de micoplasmas
- Análisis de presencia de virus adventicios
- Análisis de la presencia de endotoxinas
- Disponibilidad de muestras de representación
- Gran robustez logística y de suministro
- Soporte técnico para cuestiones relacionadas con la aplicación
- Método de detección preciso
La enzima utilizada para la digestión del ADN también debe eliminarse con eficacia durante las etapas posteriores del procesamiento y debe tenerse en cuenta su actividad a la concentración salina utilizada en el proceso. Una mayor concentración de sal puede mejorar el rendimiento del vector, no obstante no se produce interacción entre las endonucleasas convencionales y el ADN a una elevada fuerza iónica, evitando así la escisión del ácido nucleico. Esto significaba que tradicionalmente la actividad nucleasa deseada y la concentración salina tenían que estar adecuadamente equilibradas.
Desarrollo de una endonucleasa tolerante a la sal para la producción de vectores AAV
Para abordar la necesidad de una endonucleasa con actividad eficiente a las elevadas concentraciones salinas preferidas para la lisis celular, utilizamos capacidades avanzadas de ingeniería de proteínas para desarrollar la endonucleasa tolerante a la sal Benzonase®. Esta endonucleasa de origen no animal puede digerir ADN y ARN a concentraciones salinas de hasta 1000 mM y se comercializa como un producto IPEC, PQG, GMP y Emprove® Expert.
Se utiliza un sistema de expresión bacteriana para producir la endonucleasa tolerante a la sal Benzonase®, ya que garantiza un tamaño molecular definido con precisión, así como ausencia de modificaciones postraduccionales, y brinda una gran reproducibilidad de lote a lote. Los siguientes datos demuestran la actividad y las ventajas de la endonucleasa tolerante a la sal Benzonase®.
Perfil proteico
Se utiliza un sistema de expresión bacteriana para producir la endonucleasa tolerante a la sal Benzonase®, ya que garantiza un tamaño molecular definido con precisión, así como ausencia de modificaciones postraduccionales, y brinda una gran reproducibilidad de lote a lote. El perfil homogéneo de la proteína permite una detección precisa mediante inmunoanálisis (como ELISA), a diferencia de las enzimas expresadas en levadura que están muy glucosiladas y tienen un elevado perfil de variabilidad postraduccional de un lote a otro.

Figura 3.Identidad y pureza de la endonucleasa tolerante a la sal Benzonase® y una enzima de la competencia A como se muestra mediante SDS-PAGE reductora.

Figura 4.Identidad y pureza de la endonucleasa tolerante a la sal Benzonase® y una enzima de la competencia A como se muestra mediante SDS-PAGE reductora.
La producción en E. Coli de la endonucleasa tolerante a la sal Benzonase® Emprove® Expert exhibe:
- Proteína limpia y pura
- Ausencia de modificaciones postraduccionales
- Gran reproducibilidad de un lote a otro
La conclusión de las Figuras 3 y 4 demuestra que la endonucleasa tolerante a la sal Benzonase® Emprove® Expert tiene un tamaño molecular definido con precisión al contrario que la endonucleasa de referencia (Comp A) activa a concentraciones salinas elevadas.
Actividad endonucleasa
Las endonucleasas dependen del magnesio para su actividad. En la Figura 5 se compara la actividad de la endonucleasa tolerante a la sal Benzonase® y de las nucleasas no tolerantes a la sal a diferentes concentraciones de magnesio. Una concentración salina elevada aumentó la actividad de la endonucleasa tolerante a la sal Benzonase®, que se mantuvo estable en un intervalo de Mg2+ 1-10 mM y sal 500 mM. A una concentración salina 150 mM y 500 mM, la actividad de la endonucleasa tolerante a la sal Benzonase® fue similar a la de la nucleasa convencional con Mg2+ 10 mM (Figura 6).
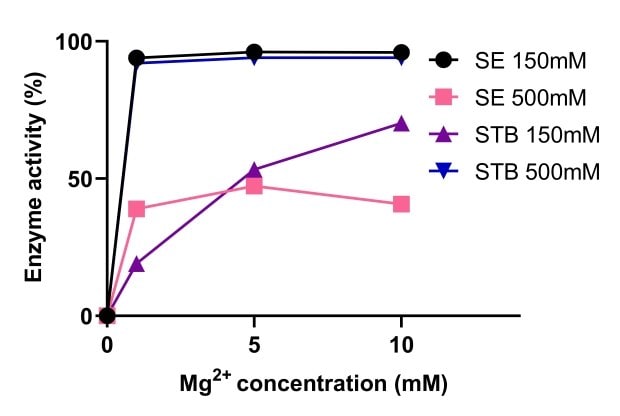
Figura 5.Comparación de la actividad de la endonucleasa tolerante a la sal Benzonase® y una endonucleasa no tolerante a la sal.
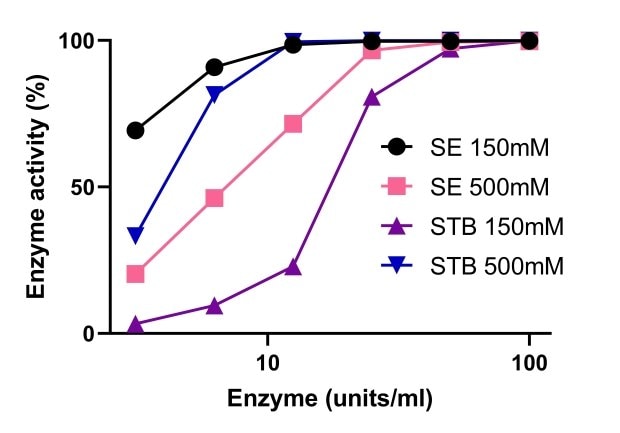
Figura 6.Comparación de la actividad de la endonucleasa tolerante a la sal Benzonase® y una endonucleasa no tolerante a la sal.
En la Figura 7 se muestran los resultados de un estudio en el que se digirió el ADN utilizando la endonucleasa tolerante a la sal Benzonase® y otras endonucleasas comercializadas activas y no activas en presencia de una concentración salina de NaCl 500 mM y 1 M durante una hora a 37 °C. La endonucleasa tolerante a la sal Benzonase® digirió por completo el ADN a 500 mM y 1 M de sal y mostró un rendimiento similar o mejor que el de la otra endonucleasa.

Figura 7.Comparación de la digestión del ADN con la endonucleasa tolerante a la sal Benzonase® y una endonucleasa comercializada activa y no activa en presencia de sal a 37°C durante una hora.
Leyenda
M – GeneRuler Ultra Low Range DNA Ladder ref. SM1213
Comp A ** – Endonucleasa activa con sal de la competencia
SE – Endonucleasa convencional como ref. 103773
STB – Endonucleasa Benzonase® tolerante a la sal Emprove® Expert
Tamaño de los fragmentos de ácido nucleico
La endonucleasa tolerante a la sal Benzonase® digiere el ADN hasta niveles indetectables por debajo del tamaño de 10 pares de bases. En la Figura 8 se muestran fragmentos de ADN en un gel de agarosa al 4 % utilizando un marcador de ADN de bajo peso molecular. A una concentración salina de 150 mM, el ADN no fue completamente digerido; a 500 mM, no quedaron fragmentos de ADN después de la digestión.

Figura 8.Fragmento de ADN de un tamaño de 25 U/ml después de la digestión con endonucleasa tolerante a la sal Benzonase® a 37°C durante 30 minutos.
Compatibilidad de la endonucleasa tolerante a la sal Benzonase® con detergentes en la producción de vectores AAV
Se evaluó la actividad de la endonucleasa tolerante a la sal Benzonase® cuando se utilizó junto con cuatro detergentes diferentes utilizados para la lisis celular: El TRITON™ X-100, el polisorbato 20 y dos detergentes alternativos, el Deviron® C16 y el 13-S9, desarrollados en respuesta a la prohibición del TRITON™ X-100. Como se muestra en la Figura 9, ninguno de los cuatro detergentes afectó a la actividad de la endonucleasa tolerante a la sal Benzonase®. El ADN fue completamente digerido en el tampón de lisis de NaCl 500 mM en presencia de TRITON™ X-100, polisorbato 20 y Deviron® 13-S9 (7B).
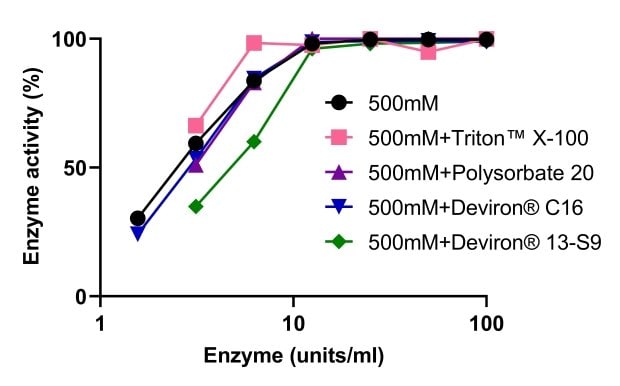
Figura 9.Actividad de la endonucleasa tolerante a la sal Benzonase® cuando se utiliza en combinación con diferentes detergentes.

Figura 10.Digestión tolerante a la sal Benzonase® del ADN cuando se utiliza en combinación con diferentes detergentes.
Selección de la Benzonase® adecuada para su aplicación
La endonucleasa tolerante a la sal Benzonase® debe utilizarse para aplicaciones en las que la concentración salina es de 200 mM o superior. A una concentración salina de 500 mM, el ADN será digerido por completo y, como se muestra anteriormente, es posible lograr un aumento del 29 % en la cantidad de AAV y una infectividad próxima al 2.000 %. La seguridad del paciente aumenta cuando se utilizan condiciones salinas elevadas en este paso intermedio, ya que se obstaculiza la agregación de los AAV y se garantiza la eliminación efectiva del ADN de las cápsides víricas. El perfil postraducional de la endonucleasa tolerante a la sal Benzonase® también asegura el uso de una proteína no glucosilada y fácil de detectar en la producción de medicamentos.
Para aplicaciones en las que la concentración salina es inferior a 200 mM, debe utilizarse la endonucleasa ordinaria Benzonase® Safety Plus.
En la Tabla 3 se resumen las especificaciones de nuestras tres referencias de endonucleasa Benzonase® GMP. La endonucleasa tolerante a la sal Benzonase® forma parte del programa Emprove® que ayuda a los fabricantes a minimizar las interrupciones y llevar a cabo evaluaciones de riesgo exhaustivas al pasar del desarrollo a la fabricación. El programa proporciona materias primas y materiales de partida que están rigurosamente cualificados según las principales normas del sector. Los materiales que forman parte del programa están respaldados por completos paquetes de documentación que satisfacen las necesidades de información de los fabricantes farmacéuticos al calificar las materias primas, completar una evaluación de riesgos y optimizar un proceso de fabricación.
Resolución del desafío de la elevada concentración salina
El uso de una elevada concentración salina durante la etapa de lisis celular en la producción de AAV ofrece mayores cantidades y una mejor infectividad. Tradicionalmente, sin embargo, este enfoque no resultaba práctico, ya que las condiciones de concentración salina elevada inhiben la actividad de las endonucleasas convencionales utilizadas para la digestión del ADN.
La disponibilidad de la endonucleasa tolerante a la sal Benzonase® permite la incorporación de concentraciones salinas del orden de 500 mM durante la fase intermedia de lisis y digestión del ADN y es compatible con todos los detergentes probados, como los Deviron®, que pueden servir como alternativas al TRITON™ X-100.
Si desea solicitar una muestra de la endonucleasa tolerante a la sal Benzonase® o del producto de la cartera Deviron®, pulse en el enlace siguiente para rellenar nuestro breve formulario web.
Benzonase® preguntas frecuentes
Definición
¿Qué es la endonucleasa Benzonase®?
Endonucleasa Benzonase® es un nombre comercial propiedad de Merck para las endonucleasas utilizadas en aplicaciones experimentales y de bioprocesamiento.
¿A qué enzimas les corresponde este nombre comercial?
La familia de endonucleasas Benzonase® alberga actualmente dos enzimas diferentes.
- La línea de productos heredados endonucleasa Benzonase®, como la endonucleasa Benzonase® Safety Plus, aislada de Serratia marcescens, y producida mediante recombinación en la cepa W3110 de E. coli K12. La proteína tiene un peso molecular de 30 kDa y un punto isoeléctrico (PI) de 6,85.
- La nueva endonucleasa tolerante a la sal Benzonase® (1.4445). Se diseñó con ingeniería de proteínas de última generación para garantizar la mayor actividad a elevadas concentraciones salinas.
La proteína es un monómero con un peso molecular de aproximadamente 27 kDa y un pI a pH 9,68. Una sección específica de estas preguntas frecuentes abarca concretamente esta enzima.
Modo de acción
¿Sobre qué tipo de ácidos nucleicos actúa la nucleasa Benzonase®? ¿Puedo utilizarla cuando aísle ARN?
La nucleasa Benzonase® es una endonucleasa promiscua que ataca y degrada todas las formas de ADN y ARN (monocatenario, bicatenario, lineal y circular).
¿Cuál es el resultado final de la degradación completa del ácido nucleico por la nucleasa Benzonase®?
La nucleasa Benzonase® digiere por completo los ácidos nucleicos a oligonucleótidos terminados en 5’-monofosfato de 2 a 5 bases de longitud.
Inhibición y eliminación
¿Cómo se puede inactivar la nucleasa Benzonase®? ¿Cómo se puede eliminar?
Puede conseguirse la inhibición reversible utilizando EDTA para quelar los iones metálicos esenciales. La inactivación irreversible solo puede lograrse en condiciones extremas (NaOH 100 mM a 70 °C durante 30 minutos). La Benzonase puede separarse del producto deseado mediante cromatografía. Sin embargo, debido a la naturaleza robusta de esta endonucleasa, recomendamos que no se utilice Benzonase si se requiere un producto final carente de nucleasa.
¿Por qué no me está funcionando la endonucleasa Benzonase®? ¿Qué inhibe su actividad?
La endonucleasa Benzonase® es activa bajo una amplia gama de condiciones de funcionamiento (véase el párrafo Características de la enzima); sin embargo, es esencial una concentración de Mg2+ 1-2 mM para la actividad de la endonucleasa Benzonase®.
El Mg2+ puede sustituirse por Mn2+; sin embargo, la enzima solo alcanzará su actividad óptima en presencia de Mg2+. Es inhibida (aproximadamente el 50 % de su actividad) por concentraciones de cationes monovalentes > 300 mM, concentraciones de fosfatos > 100 mM y concentraciones de sulfato de amonio > 100 mM. Además, concentraciones de EDTA > 1 mM inhibirán también la actividad endonucleasa Benzonase®.
Observo una pérdida de actividad. ¿por qué?
La endonucleasa Benzonase® es generalmente muy estable; sin embargo, en casos raros puede observarse una pérdida de actividad. Hay varias razones posibles para ello: la inactivación irreversible puede deberse a la presencia de desnaturalizantes en la muestra, por ejemplo, proteasas; o, alternativamente, por una conservación incorrecta. La inactivación reversible suele deberse a la presencia de quelantes como el EDTA, que eliminan los iones de magnesio esenciales.
¿Cómo elimino la endonucleasa Benzonase® de una plantilla de bioprocesamiento?
Puede conseguirse la eliminación de la endonucleasa Benzonase® utilizando varias técnicas downstream, como filtración de profundidad para clarificación, filtración por flujo tangencial (TFF) para concentración y diafiltración, y cromatografía (IEX, SEC, HIC). Consulte el Anexo, Capítulo 2 “Eliminación de la endonucleasa Benzonase® ” (página 36) si desea más información.
ESTABILIDAD Y CONDICIONES DE FUNCIONAMIENTO
Nos dejamos la endonucleasa Benzonase® fuera en la mesa de trabajo. ¿Sigue siendo útil?
Hemos realizado extensos ensayos de estabilidad en la endonucleasa Benzonase® y hemos comprobado que es extremadamente estable. Incluso con incubaciones largas a 37 °C, la endonucleasa Benzonase® mantuvo una actividad > 90% durante varios meses.
Quiero utilizar una disolución tampón diferente. ¿Qué condiciones son absolutamente necesarias para la actividad completa de la endonucleasa Benzonase® ? ¿Qué reducirá su actividad?
La endonucleasa Benzonase® requiere Mg2+1-2 mM para su actividad. La Benzonase es inhibida (aproximadamente el 50 % de actividad) por concentraciones de cationes monovalentes > 50 %, concentraciones de fosfatos > 20 mM y concentraciones de sulfato de amonio > 25 mM.
¿Cuánta más endonucleasa Benzonase® tengo que añadir si estoy trabajando a bajas temperaturas?
La endonucleasa Benzonase® requiere Mg2+1-2 mM para su actividad. La Benzonase es inhibida (aproximadamente el 50 % de actividad) por concentraciones de cationes monovalentes > 50 %, concentraciones de fosfatos > 20 mM y concentraciones de sulfato de amonio > 25 mM.
APLICACIONES DE EXTRACCIÓN DE PROTEÍNAS
¿Es la endonucleasa Benzonase® compatible con las combinaciones de inhibidores de proteasas?
Sí. Sin embargo, hay que tener cuidado ya que muchas combinaciones de inhibidores de proteasas incluyen EDTA. Concentraciones de EDTA superiores a 1 mM inhibirán la actividad de la endonucleasa Benzonase® .
Mi proteína es insoluble y tengo que purificarla en condiciones desnaturalizantes. ¿Seguirá funcionando la endonucleasa Benzonase® en urea?
En realidad la actividad de la endonucleasa Benzonase® aumenta en presencia de urea a concentraciones de hasta 6 M. A 6 M de urea, la actividad enzimática primero aumenta, luego disminuye con el tiempo. A una concentración de urea de 7 M, la endonucleasa Benzonase® se desnaturaliza después de 15 minutos y pierde su actividad. Sin embargo, se produce degradación significativa de los ácidos nucleicos antes de la inactivación. Las concentraciones iniciales más elevadas de la endonucleasa Benzonase® pueden compensar parcialmente los efectos de la urea 7 M.
¿Por qué tienen tantas variedades de endonucleasa Benzonase®? ¿Qué significa HC? ¿Qué impacto tiene el 90 % de pureza frente al 99 %?
Para cubrir la gama más amplia posible de requisitos de procesamiento y costes, la endonucleasa Benzonase® está disponible en dos grados de pureza diferentes: grado de pureza I (>99 % de pureza) y grado de pureza II (>90 % de pureza). Ambos grados están disponibles a 25 U/μl o a una concentración elevada (HC, en inglés), que se define como 250 U/μl. Para compras a granel, póngase en contacto con los servicios de atención al cliente.
Si desea una lista completa de los productos Benzonase® y las diferencias entre ellos, visite nuestra página de endonucleasas aquí.
¿Cuál es el resultado final de la degradación completa del ácido nucleico por la endonucleasa Benzonase®?
La endonucleasa Benzonase® digiere por completo los ácidos nucleicos a oligonucleótidos terminados en 5’-monofosfato de 2 a 5 bases de longitud.
APLICACIONES DE BIOFABRICACIÓN
¿Qué calidad y cantidad de endonucleasa Benzonase® será adecuada para una aplicación determinada?
Hay varios parámetros que influyen en la actividad de la endonucleasa Benzonase®. Por consiguiente, las condiciones óptimas variarán de un proceso a otro y deben determinarse experimentalmente. Para reducir la viscosidad, a menudo será suficiente la endonucleasa Benzonase®, grado de pureza II (≥ 90 %). Bajo condiciones analíticas ordinarias, una unidad de endonucleasa Benzonase® corresponde aproximadamente a la cantidad de enzima requerida para digerir por completo 37 µg de ADN en 30 minutos.
¿En qué etapa tengo que introducir la endonucleasa Benzonase® en mi proceso?
La respuesta a esta pregunta variará dependiendo de por qué esté utilizando la endonucleasa Benzonase®. Con suerte, los ejemplos proporcionados le ayudarán a responder esta pregunta. Sin embargo, como regla general, lo mejor es agregar la endonucleasa Benzonase® después del cultivo y antes de la etapa de captura.
¿Es inocua la endonucleasa Benzonase®?
Sí, se han realizado estudios toxicológicos con la endonucleasa Benzonase® (informes internos a disposición de los interesados). Se investigó la toxicidad sistémica después de una sola aplicación en ratones y ratas, y no se han observado efectos tóxicos ni siquiera a dosis muy elevadas. Además, no se ha observado ningún potencial mutágeno en ratones tratados por vía intravenosa, incluso con dosis muy elevadas de endonucleasa Benzonase®.
¿Por qué no se especifica el intervalo de volumen de llenado de los tubos de 5 millones de unidades?
Como la actividad (U/ml) de la endonucleasa Benzonase® puede variar entre lotes de producción, decidimos especificar las unidades por tubo, pero no el volumen. El volumen por tubo puede calcularse fácilmente a partir de la información de actividad indicada en el certificado de análisis (CoA).
ENDONUCLEASA BENZONASE® TOLERANTE A LA SAL
¿Es similar la secuencia a la de los productos Benzonase® heredados como la Benzonase® Safety Plus?
La endonucleasa tolerante a la sal Benzonase® es una enzima completamente nueva diseñada mediante ingeniería de proteínas de última generación para garantizar la mayor actividad a una concentración salina elevada. Tiene una secuencia de aminoácidos diferente en comparación con otros productos Benzonase® heredados.
¿Cuáles son las diferencias relativas a las condiciones de funcionamiento con los productos Benzonase® heredados?
En tanto que endonucleasa, la endonucleasa tolerante a la sal Benzonase® funciona en las mismas condiciones que los productos Benzonase® heredados. La excepción es la concentración de cationes monovalentes, donde recomendamos un mínimo de NaCl 300 mM.
¿Cómo inhibo esta enzima?
La enzima puede ser inhibida por la adición de EDTA o la exposición al calor.
¿Cómo elimino esta enzima?
Consulte «¿Cómo elimino la endonucleasa Benzonase® de una plantilla de bioprocesamiento?, anteriormente.
¿Cómo puedo detectar rastros de esta enzima?
Para nuestra enzima Benzonase® heredada, un kit Elisa específico completa nuestra oferta para garantizar una detección robusta de la endonucleasa tolerante a la sal Benzonase®.
¿Por qué tendría que utilizar esta enzima en lugar de otras nucleasas ordinarias?
Todas las nucleasas convencionales utilizadas para bioprocesamiento en el mercado se basan en una secuencia de aminoácidos muy similar. Esto significa que su capacidad para digerir ácidos nucleicos a concentraciones salinas elevadas es comparable y no se considera óptima.
Sus condiciones de funcionamiento eficaces para concentraciones de cationes monovalentes oscilan entre 0 y 200 mM, similar a las concentraciones salinas fisiológicas observadas en los procesos biológicos.
En paralelo, se ha demostrado que el uso de concentraciones salinas superiores, por encima de la concentración fisiológica durante la lisis de células HEK, está teniendo un impacto real en el rendimiento general del proceso. A concentraciones de NaCl 500 mM, la infectividad y la tasa general de recuperación de AAV es significativamente mayor que a concentraciones salinas de 150 mM.
El uso de una nucleasa tolerante a la sal es por tanto necesario para eliminar el ácido nucleico en estas condiciones salinas elevadas.
¿Puedo seguir utilizando las nucleasas regulares a concentraciones salinas >200 mM?
La actividad de las nucleasas regulares a concentraciones salinas superiores a las fisiológicas se reducirá drásticamente, lo que inducirá la necesidad de agregar más enzimas y hacer más complejo el proceso de purificación del fármaco. Esto conduce también a un proceso poco rentable con mayores costos de propiedad. Por esta razón, recomendamos utilizar una nucleasa tolerante a la sal.
¿Puedo emplear kits de detección de otros proveedores para detectar la endonucleasa tolerante a la sal Benzonase®? ¿Como otros kits especializados para otras nucleasas “activas en sal”?
La endonucleasa tolerante a la sal Benzonase® es una enzima completamente nueva, ningún kit de detección comercializado que no sean los nuestros puede detectarla.
Nota: cualquier producto que no se venda a través de un canal oficial Merck, donde se utilice el nombre comercial “Benzonase®”, debe considerarse una falsificación.
¿Por qué el huésped de expresión es tan importante para la producción de la enzima?
La expresión proteica puede conseguirse con múltiples plataformas de producción. Las más comunes con las basadas en levaduras y las bacterianas. Sin embargo, los productos resultantes no son similares y los perfiles de modificación postraduccional son diferentes dependiendo de la plataforma utilizada.
Las proteínas expresadas en levaduras están muy glucosiladas y modificadas, lo que puede provocar diversos problemas durante el uso del producto, como una mala precisión de detección con ensayos de anticuerpos.
La principal endonucleasa activa con sal en el mercado se expresa en levaduras.
¿Por qué la modificación postraduccional de las nucleasas puede afectar a la precisión y el rendimiento de la detección?
Las proteínas glucosiladas muestran un perfil no homogéneo (como se ve en la figura 2), no reproducible de un lote a otro. Como los métodos de detección ordinarios utilizan inmunoanálisis, los anticuerpos creados para detectar la proteína de interés no pueden cubrir el espectro completo de modificaciones observadas con la expresión en levaduras. Esto lleva a una mala precisión de detección de los métodos de detección con anticuerpos, como los kits de Elisa.
¿Cuál es el perfil toxicológico de esta enzima?
La endonucleasa tolerante a la sal Benzonase® viene con el mismo perfil toxicológico que otros miembros de la cartera de productos Benzonase®.
¿Pueden ayudarme a definir qué nucleasa sería la más rentable para mi proceso teniendo en cuenta la eficiencia y el rendimiento de todo el proceso?
Tenemos una cartera completa de nucleasas que satisfacen sus necesidades reguladoras y de condiciones de proceso. No dude en solicitar nuestro soporte MSAT (Manufacturing Science And Technology) para el desarrollo de su proceso. Nuestros expertos abarcan plantillas de fabricación completas, desde las etapas iniciales hasta el llenado final.
Deviron® preguntas frecuentes
¿Puedo seguir utilizando TRITON™ X-100 si no estoy en la Unión Europea?
La prohibición del TRITON™ X-100 la ha decidido la ECHA1 bajo la normativa REACH2 . El principal motivo fue la elevada toxicidad del producto para la salud humana y el medio ambiente. Por lo tanto, eliminar este producto de la bioproducción es una de las tendencias más candentes de la industria. Los organismos reguladoras de fuera de la Unión Europea también evaluarán el uso del producto, lo que inducirá otras prohibiciones futuras.
¿Por qué no puedo utilizar un detergente de calidad experimental para la biofabricación?
En general, los detergentes se fabrican en grandes volúmenes mediante reacciones en cadena de química orgánica. La calidad de la materia prima suele ser mala para reducir los costos de producción. Esto conduce a impurezas muy peligrosas en el producto final como la dioxina o la nitrosamina. Estos detergentes de calidad experimental se utilizan solo para aplicaciones de limpieza y no deben encontrarse cerca de la formulación de medicamentos.
¿Cuáles son los pasos clave para cambiar a Deviron®?
La cartera de productos Deviron® viene con 3 lotes disponibles de producto fabricado según GMP EXCiPACT. Pueden solicitarse ya muestras de estos lotes para cualificación. Los expedientes Emprove® que vienen con nuestros productos contienen toda la información necesaria para presentar una solicitud a las autoridades de registro sanitario. La información toxicológica es también fácilmente asequible.
Quiero probar Deviron®, pero no tengo experiencia, ¿cómo pueden ayudarme?
Para soporte relacionado con una aplicación, puede confiar en que nuestro equipo de expertos de biofabricación le guíe a través de este cambio. Póngase en contacto con su contacto Merck para obtener soporte gratuito.
¿Cuál es la diferencia entre MQ400/Emprove® Evolve y MQ500/Emprove® Expert (GMP)?
Para ayudarle con sus solicitudes de registro, hemos creado diferentes programas de documentación y calidad que le ayudarán a obtener el producto adecuado para la aplicación correcta. Pulse en los siguientes enlaces para obtener más información sobre los programas Emprove® y M-Clarity® . El Deviron® C16 Emprove® Evolve y el Deviron® 13-S9 Emprove® Expert forman parte de los más altos niveles de calidad que ofrecemos.
¿Cuáles son las concentraciones recomendadas para aplicaciones deseadas?
Para la inactivación vírica, la ASTM3 E3042-16 utilizada para TRITON™ X-100 sigue siendo hoy el documento de elección para la fabricación de anticuerpos monoclonales. Las concentraciones utilizadas en la industria varían entre 0,5 y 1% según la aplicación.
Para las aplicaciones de lisis celular, se utiliza una amplia gama de concentraciones, todas específicas del proceso. Recomendamos probar varias concentraciones en paralelo durante el desarrollo del proceso. Nuestros detergentes Deviron® son al menos igual de eficaces que el TRITON™ X-100 o los polisorbatos.
¿Podemos desarrollar un método de detección según las GMP para Deviron®?
Nuestros expertos en I+D desarrollaron métodos de detección para nuestra cartera de Deviron® que pueden transferirse a nuestros clientes. Sin embargo, para los métodos de detección de GMP, nuestro laboratorio Bioreliance® es el socio de elección. Póngase en contacto con nosotros para cualquier pregunta.
¿Es la cartera de Deviron® compatible con Benzonase® para aplicaciones de lisis celular?
Benzonase® es la referencia para la digestión del ADN en los procesos de AAV4 . La cartera de Deviron® ha sido desarrollada para ser totalmente compatible con las endonucleasas Benzonase®. No hay pérdida de actividad enzimática ni propiedad detergente con el uso combinado de las dos carteras. Los datos de aplicación pueden encontrarse en el folleto de la cartera de Deviron®.
¿Cuál es la capacidad de fabricación de la cartera de productos Deviron®?
La cartera de productos Deviron® se lanza desde nuestra planta de Darmstadt en Alemania y ya podemos ofrecer más de 100 toneladas de producto al año. No dude en proporcionarnos una previsión para analizar los plazos de entrega específicos en cada caso.
1European Chemicals Agency
2Registration, Evaluation, Authorization and Restriction of Chemicals*
3American Standard for Test Method
4Virus adenoasociados
TRITON es una marca comercial de The Dow Chemical Company (“Dow”) o de una filial de Dow, utilizado bajo licencia.
Referencias bibliográficas
Proporcionamos a nuestros clientes información y asesoramiento hasta donde alcanzan nuestro conocimiento y capacidad, pero sin obligación ni responsabilidad legal. Nuestros clientes deben respetar en todos los casos las normativas y leyes vigentes. Esto también se aplica con respecto a los derechos de terceros. Nuestra información y asesoramiento no exime a nuestros clientes de su responsabilidad de comprobar la idoneidad de nuestros productos para el propósito contemplado.
Para seguir leyendo, inicie sesión o cree una cuenta.
¿No tiene una cuenta?