ABN454
Anticuerpo oligómero anti-Tau (T22)
serum, from rabbit
Sinónimos:
Microtubule-associated protein tau oligomer, Tau oligomer, PHF-tau oligomer, Paired helical filament-tau oligomer, Neurofibrillary tangle protein oligomer
About This Item
Productos recomendados
biological source
rabbit
Quality Level
antibody form
serum
antibody product type
primary antibodies
clone
polyclonal
species reactivity
human
technique(s)
ELISA: suitable
dot blot: suitable
immunofluorescence: suitable
immunohistochemistry: suitable
immunoprecipitation (IP): suitable
neutralization: suitable
western blot: suitable
NCBI accession no.
UniProt accession no.
shipped in
wet ice
target post-translational modification
unmodified
Gene Information
human ... MAPT(4137)
General description
Specificity
Immunogen
Application
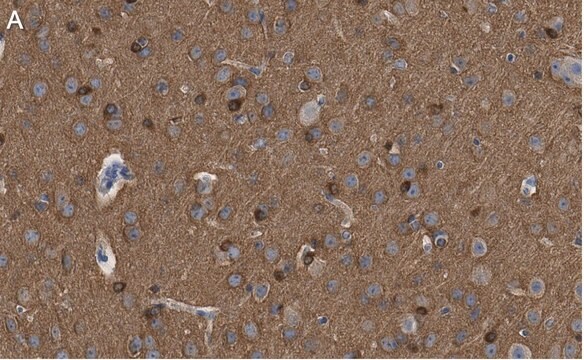
Análisis mediante inmunohistoquímica: una dilución 1:245-1 000 de un lote representativo detectó oligómeros tau en cortezas frontales de pacientes con enfermedad de Alzheimer (EA) y enfermedad de cuerpos de Lewy (LBD) (cortesía del Prof. Rakez Kayed, University of Texas, Galveston).
Análisis mediante inmunofluorescencia: un lote representativo detectó tau oligómera en cortes de tejido cerebral de encefalopatía traumática crónica (CTE), mientras que se observó poca o ninguna inmunorreactividad del oligómero tau en cortes cerebrales humanas sin ETC. La inmunorreactividad del oligómero tau se ubicó con la de tau pThr231 con una conformación cis, pero no con tau pThr231 con una conformación trans, entre pThr231 y Pro232 (Kondo, A., et al. (2015). Nature. 523(7561):431-436.).
Análisis mediante inmunofluorescencia: un lote representativo detectó inmunorreactividad de oligómero tau en cortes de corteza frontal incluidos en parafina de cerebros enfermos de Alzheimer (EA) (Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946-1959).
Análisis mediante inmunoelectrotransferencia: una dilución 1:1 .000 de un lote representativo detectó el oligómero tau en encefalopatía traumática crónica (ETC) en lisado de agregado de Tau.
Análisis de Western Blotting: lotes representativos detectaron el oligómero tau, pero no tau monómera, o cualquier otra proteína oligómera y fibrilar (Wu J.W., et al. (2013). J. Biol. Chem. 288(3):1856-1870; Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946-1959).
Análisis mediante inmunotransferencia por puntos: un lote representativo detectó oligómeros tau, pero no monómero tau ni filamentos helicoidales emparejados (PHF) (Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26 (5):1946-1959.).
Análisis mediante ELISA: lotes representativos detectaron oligómeros tau formados vitro, así como oligómeros tau en extractos cerebrales solubles en PBS de pacientes con parálisis supranuclear progresiva (PSP) (Lasagna-Reeves, C.A., et al. (2012). Sci. Rep. 2:700; Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26 (5):1946-1959.).
Análisis mediante ELISA: un lote representativo mostró reactividad selectiva hacia el oligómero tau, mientras que exhibió una inmunorreactividad muy reducida hacia fibrillas tau, y ninguna reactividad hacia tau monómera, u otros oligómeros o fibrillas de proteínas (por ejemplo, Aβ, α-sinucleína, o polipéptido amiloide de islotes) (Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26 (5):1946-1959.).
Análisis mediante Inmunoprecipitación: lotes representativos causaron inmunoprecipitación del oligómero tau procedente de cerebros de enfermos de Alzheimer (EA), pero no los cerebros sin EA (Lasagna-Reeves, C.A., et al. (2012). Sci. Rep. 2:700; Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946-1959).
Análisis de neutralización: lotes representativos neutralizaron la toxicidad del oligómero tau a las células del neuroblastoma humano SH-SY5Y (Lasagna-Reeves, C.A., et al. (2012). Sci. Rep. 2:700; Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26 (5):1946-1959.).
Análisis mediante inmunohistoquímica: un lote representativo detectó inmunorreactividad del oligómero tau en cortes cerebrales incluidos en parafina de pacientes con parálisis supranuclear progresiva (PSP) (Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946-1959).
Neurociencia
Enfermedades neurodegenerativas
Quality
Análisis mediante inmunoelectrotransferencia: una dilución 1:1 000 de este anticuerpo detectó oligómeros tau en lisado de tejido cerebral humano de enfermos de Alzheimer (EA), pero no tejido sin EA.
Target description
Physical form
Storage and Stability
Recomendaciones de manipulación: Tras su recepción, y antes de quitar la tapa, centrifugue el vial y mezcle suavemente la disolución. Distribúyalo en alícuotas en tubos de microcentrífuga y guárdelo a -20°C. Evite ciclos repetidos de congelación y descongelación que pueden dañar la IgG y afectar al rendimiento del producto.
Disclaimer
¿No encuentra el producto adecuado?
Pruebe nuestro Herramienta de selección de productos.
Storage Class
10 - Combustible liquids
wgk_germany
WGK 1
Certificados de análisis (COA)
Busque Certificados de análisis (COA) introduciendo el número de lote del producto. Los números de lote se encuentran en la etiqueta del producto después de las palabras «Lot» o «Batch»
¿Ya tiene este producto?
Encuentre la documentación para los productos que ha comprado recientemente en la Biblioteca de documentos.
Nuestro equipo de científicos tiene experiencia en todas las áreas de investigación: Ciencias de la vida, Ciencia de los materiales, Síntesis química, Cromatografía, Analítica y muchas otras.
Póngase en contacto con el Servicio técnico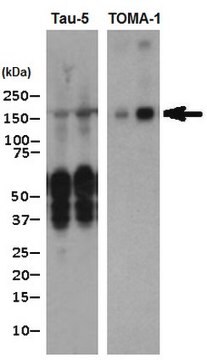




![3-[1,3-Dihydro-4-(5-hydroxy-1-pentyn-1-yl)-1-oxo-2H-isoindol-2-yl]-2,6-piperidinedione ≥95.0%](/deepweb/assets/sigmaaldrich/product/structures/165/184/ebc29f1b-f63f-4e48-afb5-b3aa4c69795a/640/ebc29f1b-f63f-4e48-afb5-b3aa4c69795a.png)


