膳食抗氧化剂
抗氧化剂可保护生物系统免受含氧自由基和氧化还原过渡金属离子(如铁、铜和镉)引起的氧化损伤。1在线粒体内的葡萄糖氧化代谢过程中,会产生辅酶 Q 复合物 III 还原副产物超氧阴离子 (O2 –)。通过超氧化物歧化酶将超氧阴离子转化为过氧化氢 (H2O2),过氧化氢又可转化为过氧自由基 (RO2•)、羟基自由基 (OH–•) 或次氯酸根 (ClO–) 离子。超氧阴离子还可以与一氧化氮 (NO) 反应,形成高反应活性的过氧亚硝酸盐 (ONOO–•)。2正常条件下,这些细胞氧化剂会被细胞内的各种抗氧化剂和抗氧化酶还原或去除,主要是谷胱甘肽、 硫氧还蛋白、超氧化物歧化酶、过氧化氢酶和过氧化物酶。膳食抗氧化剂,如抗坏血酸(维生素 C)、维生素 E、β-胡萝卜素和其他类胡萝卜素以及硒,是公认的细胞和血浆总抗氧化能力重要参与者。类胡萝卜素叶黄素和玉米黄质是眼睛和视网膜中重要的抗氧化剂。3维生素E是生育酚和生育三烯酚的混合物(其中α-生育酚是主要的抗氧化剂)4,是细胞中主要的脂溶性抗氧化剂,负责保护膜脂免遭过氧化。2首先通过低密度脂蛋白 (LDL) 将维生素 E 携带到细胞中,随后向脂肪过氧自由基提供氢防止 LDL 过氧化。5多酚化合物(尤其是类黄酮)最近经证是培养细胞中有效的抗氧化剂。对类黄酮进行的人体研究也证明了这一作用,部分源于其抗氧化作用。6抗氧化剂可直接充当还原剂向不成对氧电子提供质子氢,或者稳定或重新定位自由基电子。7在此过程中 还原剂被氧化;例如,两个谷胱甘肽分子的半胱氨酰硫氢基被氧化,形成氧化型谷胱甘肽的分子间胱氨酸(图1)。
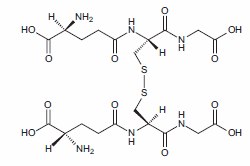
图 1.氧化型谷胱甘肽结构
硫辛酸是一种内源性抗氧化剂,最近作为膳食补充剂引起了人们的关注——它不仅可以清除自由基,二氢硫辛酸形式更是一种非常有效的还原剂。硫辛酸可还原其他抗氧化剂的氧化形式,最终维持组织浓度的还原型谷胱甘肽。8
部分抗氧化剂可捕获或清除自由基,并在此过程中自身变成自由基。在类胡萝卜素虾青素(图 2)、叶黄素和玉米黄质清除氧自由基时,不成对电子的电荷在分子的整个多烯链上离域。9黄酮醇槲皮素氧化成可与硫醇反应的醌。10黄酮类化合物还是极好的金属离子螯合剂,可以防止铜催化的 LDL 过氧化。1,4,11 二苯乙烯植物抗毒素白藜芦醇在螯合铜和防止 LDL 过氧化方面比黄酮类化合物更有效。12这可能有助于白藜芦醇和类黄酮的抗动脉粥样硬化作用。

图 2.虾青素结构M
类黄酮和类胡萝卜素是主要的膳食抗氧化剂,在水果和蔬菜中普遍存在。流行病学研究表明,在饮食富含这些植物化学物质的人群中,各类氧化应激相关慢性疾病的发病率也较低,如动脉粥样硬化、糖尿病、神经退行性疾病和癌症。8然而,目前就多酚的体内作用机制仍存在很大分歧。多酚被身体视为外源物质,并在肠壁和肝脏中快速代谢和结合。除了儿茶素的没食子酸结合物(例如表没食子儿茶素没食子酸酯)13,血液中的大多数黄酮类化合物都是葡萄糖醛酸、硫酸盐或 O-甲基化结合物。4,14这类结合物基本上缺乏抗氧化活性。15Moskaug 等人推断黄酮类化合物通过诱导细胞中慢性、低水平的氧化应激来增强细胞抗氧化系统,从而增强细胞抗氧化防御系统(毒物兴奋效应)。15Halliwell 等人认为微摩尔浓度的未吸收类黄酮和其他酚类物质存留在小肠和结肠中,它们的抗氧化、金属螯合和其他作用可防止结直肠癌的发生。4
最近的研究证实,多酚除了清除自由基和螯合金属离子之外,还具有许多胞内作用。活性氧(ROS)和活性氮(RNS)也是潜在的信号分子。它们通过一类氧化还原敏感转录因子调控基因表达,包括诱导抗氧化/解毒酶表达的 Nrf2,以及诱导炎症细胞因子、细胞粘附分子、急性期蛋白产生且抗凋亡的 NFkB 和 AP-1。1,2,16这些转录因子因氧化应激而激活;ROS 浓度持续升高可诱导其抑制亚基 IkB 磷酸化和解离,从而激活 NFkB。据报道,水飞蓟素和水飞蓟宾(统称水飞蓟宾)17、儿茶素和原花青素1,11,以及其他类黄酮16可以阻断 NFκB 激活。
Forman 等人提及的证据表明,过氧化氢和超氧阴离子通过介导氧化还原信号反应而表现出第二信使的特性。他们推断过氧化物与信号蛋白活性位点中存在的关键半胱氨酸硫醇盐可逆地相互作用。18蛋白质酪氨酸磷酸酶和硫氧还蛋白确知具有硫醇盐形式的活性位点半胱氨酸,而 AP-1 和 NFκB 转录因子以及部分半胱天冬酶具有氧化还原敏感的半胱氨酸(可能为硫醇盐形式)。某些蛋白激酶 C 亚型调节位点中的锌结合半胱氨酸也可能被过氧化氢氧化。受体刺激产生过氧化物还会导致所有有丝分裂原激活的蛋白激酶途径(ERK、JNK 和 p38 MAPK)激活。其他信号蛋白和酶则是一氧化氮、过氧化物或这两种氧化剂共同的靶标(表 1)。因此,清除活性氧中间体的抗氧化多酚可能对介导细胞对氧化应激反应的细胞内信号转导途径产生深远影响。
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?