在流式细胞分析方案中,主要步骤的任何细微细节都可能对数据结果造成重大影响。大多数流式细胞分析实验方案都存在4个主要步骤:
样品制备
任何可制成单细胞悬液的细胞群均可用于流式细胞分析。制备时需要注意以下三个要点:
- 制备细胞群离体样品时,通常要用机械分离方法轻柔匀浆化新切组织,并通过密度梯度离心法分离不同类型细胞,以便去除细胞外基质、碎片和无关细胞群。
- 需要特别注意的是,在使用前,贴壁细胞必须先用酶液或钙螯合剂与吸附的细胞培养容器解离。
- 悬浮细胞可直接进行计数和活力检测。
细胞数/滴度特指悬液中的活细胞数量,可使用自动细胞计数仪,经设门排除死细胞/碎片后进行测定。此外,也可通过对已知体积的活细胞进行显微镜辅助计数从而检测细胞活力。比如可配套使用血球计数板和台盼蓝染料,其中活细胞由于细胞膜完整,可拒染台盼蓝,只有失去活力的死细胞才会吸收这种染料。
封闭
为防止一抗与悬液细胞非特异性结合,需要使用抗Fc抗体稀释液(特异性针对样本种属),防止抗体的Fc片段或恒定区与大多数细胞类型上都存在的Fc受体结合。通常取少量Fc封闭液加入洗涤后细胞进行封闭孵育。完成后无需洗涤,立即加入染色抗体稀释液,确保非特异性抗体结合的封闭效果持续存在。
抗体孵育
一抗孵育
不同于其他基于抗体的应用(如免疫组化分析),流式细胞分析的抗体稀释度计算通常并不基于单位体积缓冲液所需的抗体用量,而是基于样本中单位细胞数目所需的抗体用量。与其他应用一样,最佳稀释浓度必须通过实验测定。可使用流式细胞检测缓冲液稀释抗体。少量染色有助于提高抗体与悬液细胞的接触几率。孵育结束后,应使用染色或检测缓冲液洗涤细胞至少三次,以便去除所有未结合的一抗。
二抗孵育
进行间接法检测时,一抗孵育后需再使用适当稀释的特异性针孵育一抗同型的二抗。在多色流式检测实验中,每种二抗都必须搭配波长或颜色明显不同的荧光染料,以便充分区分不同靶标信号。二抗孵育必须遮光保护光敏感性荧光染料,而样品应同之前一样应始终在冰上且在4°C下离心。
荧光染料
流式细胞分析所用的抗体很多都会直接偶联荧光染料;不过,很多未标记一抗则通常与标记二抗联合使用。流式细胞分析最常用的两种荧光染料是异硫氰酸荧光素(FITC)和藻红蛋白(PE)。这两种染料之所以能成为首选标记是因为2个关键特性,一是它们均由488 nm激光激发,二是它们的发射光谱不同:FITC为530 nm(绿色),PE为570–575 nm(橙色)。随着荧光染料化学和流式细胞分析仪器发展,已实现多于两种原始染料的多重同步细胞标记和分选。

图 1.FluoroFinder® Spectra Viewer光谱查看器上多种荧光染料的激发和发射波长输出。从左到右依次为mFluor 450、Alexa Fluor 488、PE、APC、iFluor 700和iFluor 750。
给定流式细胞分析实验可检测参数的最大数目取决于可用光源和检测器数目。配置多个激光器的流式细胞仪让研究人员可以同时使用多种不同激发光谱的荧光染料,扩大了可用的抗体数目。此外,由于仪器可逐个采集平行排列的各激光器依次激发单个颗粒发出的信号,通过多激光与多通道的组合甚至可以区分激发光谱不同、发散光谱却相似的两种荧光染料。
选择合适荧光染料的技巧:
- 了解仪器检测范围,选择最亮的荧光染料。
- 根据仪器检测范围,应尽量选择减少光谱重叠的荧光染料。
- 为弱表达的抗原保留强荧光染料,反之亦然。
- 对检测灵敏度需求较高的细胞亚群,应避免高表达的细胞因光谱重叠问题对其产生干扰。
- 避免复合荧光染料的降解,及其对结果可能的影响。
如需了解更多关于合适荧光染料的选择,可参阅我们在为您的流式细胞实验选择正确的荧光染料和构建用于多色流式细胞仪分析的最佳面板中的相关指南。
固定和储存
表面抗原染色完成后,如不急于重悬细胞进行检测,可立即用多聚甲醛(溶于磷酸盐缓冲液)对细胞进行固定处理。样品染色后无法立即进行检测时,如此处理可在4°C下过夜储存细胞。之后,应稀释固定剂并至少洗涤细胞两次。虽然建议染色后立即进行检测,但固定后的固定细胞最多可在4°C下避光保存48小时。
细胞内靶标分析:细胞破膜
当目标抗原位于细胞内时,表面染色结束后必须固定细胞提高结构强度,使细胞能够抵抗后续需要执行的破膜操作(让抗体能接触到细胞内抗原)。完成固定和洗涤步骤的细胞破膜时,可采用适合的去垢剂(溶于磷酸盐缓冲液)室温孵育至多15分钟,之后稀释去垢剂溶液并洗涤细胞一次。推荐使用非离子型去垢剂,如皂素。所有涉及抗体或链霉亲和素的步骤都必须持续维持破膜效果,因此需在荧光染料孵育及后续所有染色步骤的染色缓冲液中掺入去垢剂。通过流式细胞分析检测细胞内抗原的方法遵循上述原则和程序,包括直接法、间接法或信号增强的直接/间接混合法。
数据采集
现有大多数流式细胞仪都配有必要的软件,以便对每个细胞通过检测器时生成的颗粒特性信号进行采集和转化。这类软件程序通常包含辅助实验安排的组件——该组件功能对于多标本的多样本分析尤其重要。
进行多色实验时,考虑到实验中所用各种荧光染料会产生的光谱重叠现象,设置荧光补偿参数尤为重要。荧光补偿可以校准每种荧光染料的光谱,消去光谱重叠带来的相邻通道信号。
如果您的实验未得到高质量的结果,可查看我们的流式细胞故障排除指南以获取应对常见挑战的建议。

图 2.双参数流式图显示如何利用细胞的光散射特性确定目标细胞群,此处为细胞大小(前向散射)和内部复杂程度(侧向散射)两个特性。接着使用用户指定的门或区域确定目标亚群(此处,红色椭圆圈定的是可能的活性细胞亚群),以便重点分析。
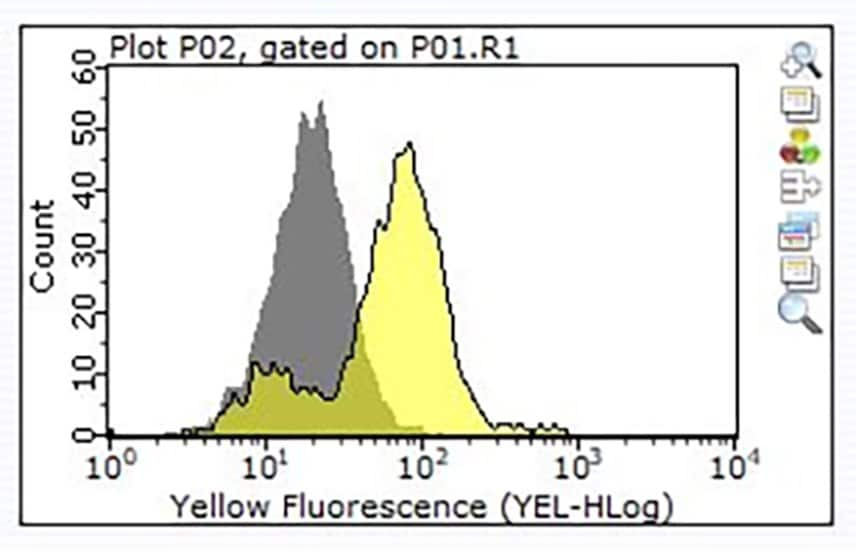
图 3.一百万个Raji细胞染色,先使用1μg货号ZRB1564,ZooMAb® CD24(克隆号3N22)单克隆抗体(黄色直方图)或等量的兔IgG同型对照(灰色直方图),再使用PE标记的驴抗兔IgG二抗。
如要继续阅读,请登录或创建帐户。
暂无帐户?