MABS1254
Anticuerpo anti-O- GlcNAc, clon CTD110.6
clone CTD110.6, from mouse
Sinónimos:
O-GlcNAc, beta-O-GlcNAc, O-Linked N-Acetylglucosamine, beta-O-linked N-acetylglucosamine
About This Item
Productos recomendados
biological source
mouse
Quality Level
antibody form
purified immunoglobulin
antibody product type
primary antibodies
clone
CTD110.6, monoclonal
species reactivity (predicted by homology)
all
technique(s)
ELISA: suitable
immunoprecipitation (IP): suitable
western blot: suitable
isotype
IgMκ
target post-translational modification
glycosylation
Gene Information
human ... OGT(8473)
General description
Specificity
Immunogen
Application
Análisis mediante ELISA: un lote representativo detectó el péptido (YSPTSPS) del dominio C-terminal (CTD) de la ARN polimerasa II con una sola serina o treonina O-GlcNAciladas, pero no el péptido no modificado correspondiente (Comer, F.I., et al. (2001). Anal. Biochem. 293(2):169-177).
Análisis mediante inmunoprecipitación: un lote representativo causó inmunoprecipitación de proteínas O-GlcNAciladas procedentes de células madre pluripotentes humanas (hPSC) (Maury, J.J., et al. (2013). Stem Cell Res. 11(2):926-937).
Análisis mediante inmunoprecipitación: un lote representativo causó inmunoprecipitación de proteínas O-GlcNAciladas procedentes de extractos de células HeLa (Comer, F.I., et al. (2001). Anal. Biochem. 293(2):169-177).
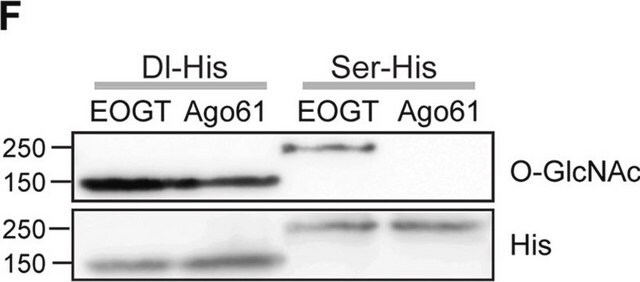
Análisis mediante inmunoelectrotransferencia: un lote representativo detectó niveles similares de O-GlcNAcilación celular en células madre pluripotentes humanas (hPSC) no diferenciadas, en diferenciación y terminalmente diferenciadas (Maury, J.J., et al. (2013). Stem Cell Res. 11(2):926-937).
Análisis mediante inmunoelectrotransferencia: un lote representativo detectó el péptido (YSPTSPS) del dominio C-terminal (CTD) de la ARN polimerasa II conjugada con BSA con beta-O-GlcNAc, pero no con alfa-O-GlcNAc, ni el péptido no modificado correspondiente. La presencia de GlcNAc, pero no de GalNAc, abolió la detección de las bandas buscadas (Comer, F.I., et al. (2001). Anal. Biochem. 293(2):169-177).
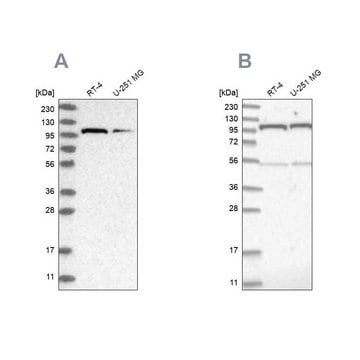
Análisis mediante inmunoelectrotransferencia: un lote representativo detectó proteínas O-GlcNAciladas en extracto nuclear HeLa, así como proteínas O-GlcNAciladas purificadas a partir del extracto citosólico y nuclear HeLa mediante columna de aglutinina de germen de trigo (WGA). El bloqueo de los anticuerpos por péptido inmunógeno antes de la inmunotransferencia abolió la detección de bandas buscadas (Comer, F.I., et al. (2001). Anal. Biochem. 293(2):169-177).
Análisis mediante inmunoelectrotransferencia: un lote representativo detectó un aumento de proteínas O-GlcNAciladas en células Jurkat tratadas con el inhibidor de la glucosaminidasa PUGNAc y la glucosamina intermediaria de la vía de la hexosamina (Comer, F.I., et al. (2001). Anal. Biochem. 293(2):169-177).
Comunicación molecular
Modificación postraduccional general
Quality
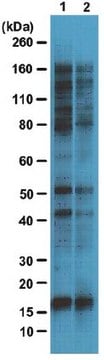
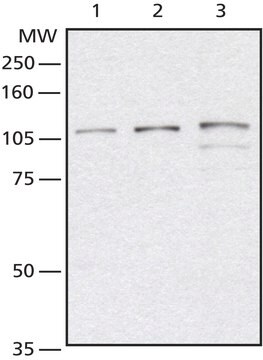
Análisis mediante inmunoelectrotransferencia (western blot): 4,0 µg/ml de este anticuerpo detectaron proteínas O-GlcNAciladas en 10 µg de lisado de células HeLa.
Target description
Physical form
Storage and Stability
Other Notes
Disclaimer
¿No encuentra el producto adecuado?
Pruebe nuestro Herramienta de selección de productos.
Storage Class
10 - Combustible liquids
wgk_germany
WGK 2
flash_point_f
Not applicable
flash_point_c
Not applicable
Certificados de análisis (COA)
Busque Certificados de análisis (COA) introduciendo el número de lote del producto. Los números de lote se encuentran en la etiqueta del producto después de las palabras «Lot» o «Batch»
¿Ya tiene este producto?
Encuentre la documentación para los productos que ha comprado recientemente en la Biblioteca de documentos.
Nuestro equipo de científicos tiene experiencia en todas las áreas de investigación: Ciencias de la vida, Ciencia de los materiales, Síntesis química, Cromatografía, Analítica y muchas otras.
Póngase en contacto con el Servicio técnico